近日,上海科技大学iHuman研究所Raymond Stevens课题组在国际学术期刊Redox Biology上发表了题为“Redox compartmentalization drives functional heterogeneity of mature insulin secretory vesicles in pancreatic β-cells”的研究论文,首次揭示了成熟胰岛素分泌囊泡的氧化还原异质性特征,初步探讨了其与胰岛β细胞功能调控的潜在关联,为深入研究β细胞功能障碍相关代谢性疾病(如2型糖尿病等)的发病机制提供了新视角。

胰岛素分泌囊泡是胰岛β细胞中储存和释放胰岛素的关键细胞器,对维持血糖稳态至关重要。尽管已有研究提示囊泡群体存在功能差异,但其在氧化还原水平的异质性及其调控机制一直未被明确。本研究创新性地利用神经肽(NPY)与荧光探针DsRed1-E5(Timer)构建了一套新型氧化还原检测系统,成功在INS-1E和人源Endoc-βH5细胞中解析出胰岛素分泌囊泡的不同氧化还原亚群,并通过Grx1-roGFP2工具进一步验证了囊泡氧化还原异质性的存在。研究发现,KRBH缓冲液处理可显著提高细胞质和线粒体的氧化水平,并放大分泌囊泡的氧化还原差异,其中谷氨酰胺剥夺是关键驱动因素。
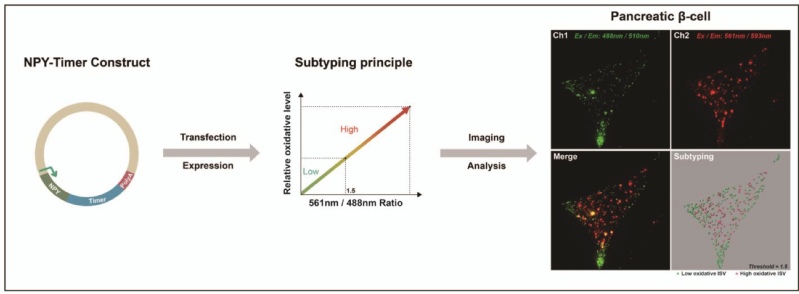
图1. NPY-Timer荧光探针系统工作原理及其在胰岛分泌囊泡氧化还原检测中的应用。
进一步分析表明,低氧化态囊泡多分布于细胞膜附近(0-1μm),分泌响应更强;而高氧化态囊泡则更多位于胞内深处(>1μm),动态性更高且易被靶向至溶酶体降解。在葡萄糖刺激下,低氧化态囊泡表现出更优异的胰岛素囊泡释放能力。此外,在模拟2型糖尿病的糖脂毒性环境中,囊泡氧化水平显著上升,提示氧化还原稳态受损可能与疾病进展相关。
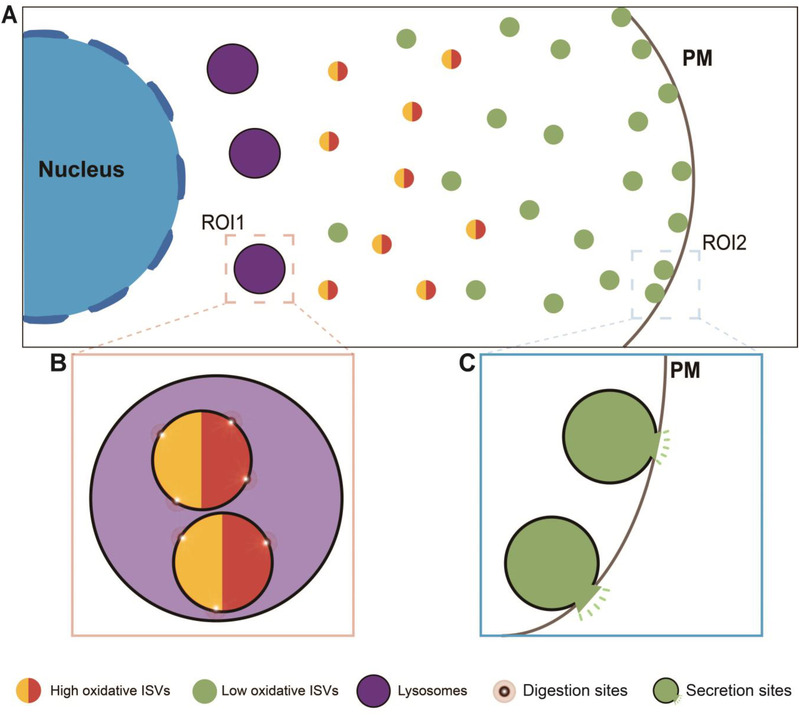
图2. 成熟胰岛素分泌囊泡氧化还原异质性功能分布模式图。
本研究不仅首次建立了胰岛素分泌囊泡氧化还原状态的检测与分析方法,填补了相关研究空白,也为进一步探索线粒体-囊泡间氧化信号传递机制及其在胰岛素分泌调控中的作用奠定了基础。相关成果有望为2型糖尿病的药物评价及新治疗策略开发提供重要参考。
上海科技大学生命科学与技术学院2021级博士研究生庄路和2023级硕士研究生赵雨薇为论文共同第一作者,iHuman研究所副研究员刘艳为通讯作者,上海科技大学为唯一完成单位。


