近日,上海科技大学iHuman研究所Kurt Wüthrich团队在《细胞化学生物学》(Cell Chemical Biology)在线发表题为“Structural basis of adenosine 2A receptor balanced signaling activation relies on allosterically mediated structural dynamics”的研究论文,揭示了人源腺苷2A受体的激活依赖于由别构介导的跨膜区胞内侧结构有序度丧失。

腺苷受体是人体内826种G蛋白偶联受体的重要亚群,在多种生理过程中发挥关键作用,已成为药物研发的重要靶点。其中,腺苷2A受体(A2AAR,又称“咖啡因受体”)研究较为深入,相关药物已用于帕金森病治疗,并在肿瘤免疫治疗领域进入临床研究阶段。
A2AAR作为细胞膜蛋白,可将胞外配体的化学信号转导至胞内,这一过程依赖于正构配体结合位点与胞内侧之间的别构偶联。由于人源G蛋白偶联受体固有的不稳定性,难以在接近生理温度下捕捉其七次螺旋跨膜结构域的动态构象变化,这些动态变化与信号转导的具体关系尚未明晰。
为破解这一难题,研究团队采用基因密码子扩展技术,在A2AAR中构建了一套对结构高度敏感的19F核磁探针网络(图1A),在原子水平追踪了跨膜区在配体结合中的构象变化,揭示了信号跨膜传递的结构基础。研究发现,受体对G蛋白与阻遏蛋白信号通路的无偏向性激活,与跨膜区胞内侧结构有序度的丧失密切相关(图1A和1B)。该过程由正构配体结合位点触发,通过别构效应远程传递。失活突变体A2AAR[D52N]的实验进一步验证了该机制:D52N点突变对A2AAR的晶体结构无明显影响,但消除了受体的信号活性并抑制跨膜区胞内侧结构有序度丧失(图1C)。
研究表明,A2AAR的激活依赖“整体结构保持、局部有序度丧失”的别构机制,为开发偏向性配体提供了新思路,即通过限制局部结构有序度丧失,实现信号通路的精准调控。
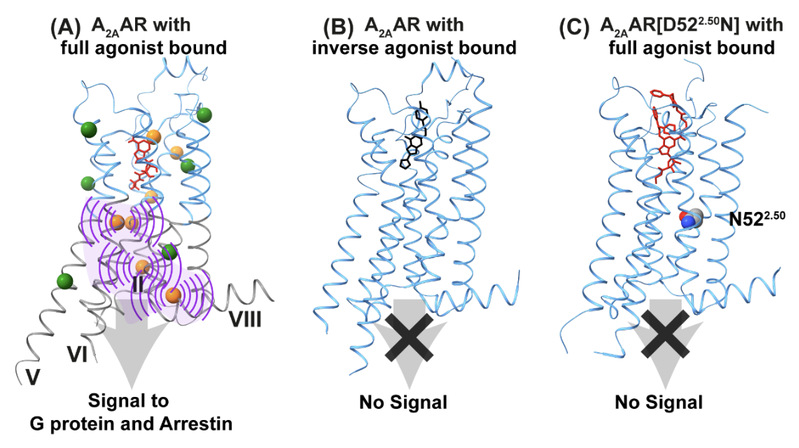
图1 A2AAR的结构动态与激活的关系
上海科技大学iHuman研究所博士后郭灿泳为论文的第一作者,特聘教授Kurt Wüthrich为通讯作者,上海科技大学为第一完成单位。
论文链接:https://www.sciencedirect.com/science/article/pii/S2451945625002582?dgcid=author


