近日,上海科技大学iHuman研究所徐菲课题组与华中科技大学刘剑峰团队合作,在《自然·通讯》(Nature Communications)上发表了题为“Structural insights into the regulation of monomeric and dimeric apelin receptor”的研究论文,系统解析了爱帕琳肽受体(apelin receptor, APJR)在单体与二聚体状态下的配体结合和信号调控机制,揭示了G蛋白偶联受体(G protein-coupled receptor, GPCR)二聚化对配体识别及信号调控的重要影响。这一发现不仅深化了对GPCR信号转导机制的理解,也为肥胖、心血管疾病以及衰老相关的疾病新药研发提供了重要的理论支撑。

徐菲课题组长期致力于Apelin受体研究,继2017年率先在国际上发表首个APJR晶体结构,以及2022年首次揭示APJR的单体/二聚体与下游Gi蛋白复合物结构后,此次利用单颗粒冷冻电镜技术进一步解析了APJR在结合内源性多肽配体apelin-13时, 以单体和二聚体状态与Gi蛋白结合的复合物结构(APJR: Gi蛋白分别为1:1和2:1)(图1)。此外,团队还解析了无配体状态下(apo)的APJR二聚体结构,并利用先前研究报道的功能性纳米抗体(激动剂JN241-9与拮抗剂JN241),系统考察了配体结合对APJR结构及二聚体动态变化的影响,揭示了在受体激活过程中,二聚体中两个单体之间可能存在负向变构调控的特征。
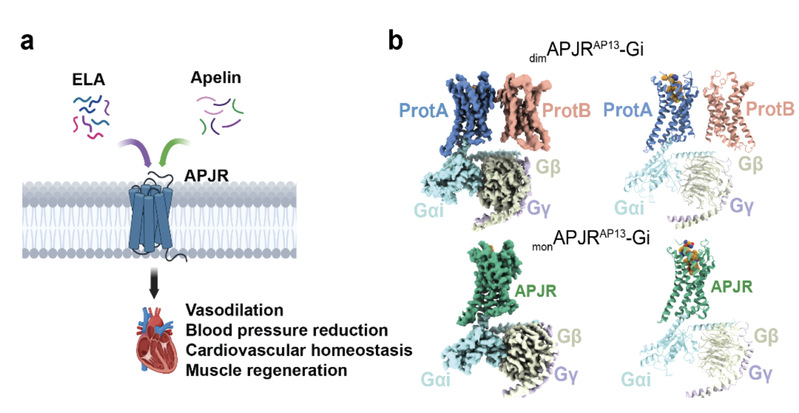
图1:APJR二聚体-Gi和APJR单体-Gi复合物结合apelin-13的冷冻电镜结构。(a)两种内源性多肽配体对APJR产生的药理学效应模型。(b)Apelin13-APJR二聚体-Gi复合物和Apelin13-APJR单体-Gi复合物的冷冻电镜密度图及三维结构模型。
研究发现,APJR二聚体在结合不同配体(如Apelin和ELA两种内源性多肽)时展现出显著的差异化结合模式:Apelin主要作用于与Gi蛋白结合的APJR单体(图1),而ELA则同时作用于两个APJR单体。同时,拮抗剂抗体JN241以及无配体状态下(apo)的APJR二聚体结构更为紧凑,而结合apelin-13以及G蛋白之后,二聚体内部之间的距离变大(图2)。值得关注的是,研究还解析了分别在有无G蛋白结合情况下的激动剂抗体JN241-9与APJR的复合物结构(图2):在G蛋白不存在的情况下,结合激动剂抗体JN241-9的APJR主要以二聚体形式存在;而当G蛋白存在并结合时,结合激动剂抗体JN241-9的APJR主要处于单体形式(图2)。该研究首次揭示了G蛋白偶联可能在APJR激活过程中起到促进二聚体解离的作用。在此基础上,研究团队通过分子动力学模拟、突变与功能验证,并结合已解析的多个APJR不同功能状态下的单体和二聚体结构,全面揭示了APJR从非活性到活性状态的动态调控机制。这一系统性研究为理解APJR的信号传导及调控提供了全新视角。
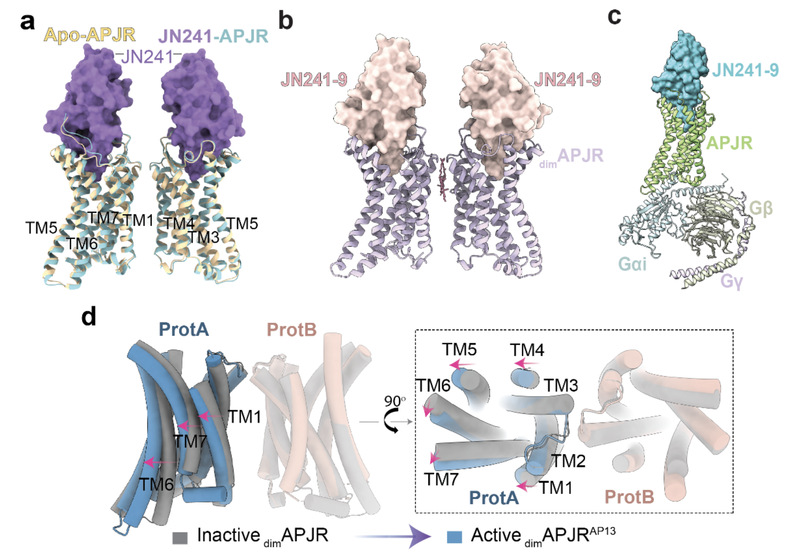
图2:不同状态下APJR二聚体与单体的构象转化。(a)JN241-APJR与apo-APJR结构的叠合。(b)JN241-9-APJR二聚体复合物的三维结构模型,APJR基本处于二聚体状态。(c)JN241-9-APJR–Gi复合物的三维结构模型,APJR基本处于单体状态。(d)APJR二聚体由抑制状态(JN241结合的对称二聚体)转变为激活状态(apelin-13结合的非对称二聚体)。叠加基于ProtB,并用红色箭头标注ProtA从抑制到激活状态的运动。
Apelin受体因其在肥胖、心血管疾病、肌肉再生及衰老过程中的关键作用,被认为是颇具潜力的药物靶点,特别是与目前广泛开发的GLP-1R靶点联合作用,显示了卓越的减肥增肌疗效,具有广阔的药物研发前景。相较于多肽和小分子药物,抗体等大分子药物在慢性代谢类疾病治疗中具有更优越的长效性和安全性。本研究首次揭示了两个功能性纳米抗体结合APJR的分子机制,提供了抗体与靶点相互作用的清晰图谱,为抗体药物设计和优化提供了精准模板。徐菲课题组针对Apelin受体的长期系统性研究以及对一系列复合物结构的深入解析为GPCR信号转导和药理学领域提供了新思路,也为开发针对心力衰竭、肥胖及衰老相关疾病的创新药物奠定了坚实基础。
上海科技大学iHuman研究所高级工程师岳洋、iHuman研究所副研究员武丽杰、生命科学与技术学院2024届博士研究生刘立尔以及华中科技大学副研究员许婵娟为该论文共同第一作者;华中科技大学刘剑峰教授和上海科技大学iHuman研究所、生命学院常任正教授徐菲为共同通讯作者。上海科技大学为第一完成单位。
论文链接:https://www.nature.com/articles/s41467-024-55555-6


