近日,上海科技大学iHuman研究所华甜课题组与合作者在国际学术期刊《细胞研究》(Cell Research)上发表了题为“Structure basis of ligand recognition and activation of GPR55”的研究论文,揭示了孤儿受体GPR55结合反向激动剂的非激活态三维结构和无配体结合的GPR55与下游G13蛋白复合物的三维精细结构,在分子水平阐述了GPR55反向激动剂的配体识别机制和受体激活机制。本研究为靶向GPR55的新型配体设计提供了精准的结构模型,为深入探索GPR55的生理和病理作用奠定了理论和实验基础。
随着对大麻素系统研究的逐步深入,人们发现一些内源性大麻素(AEA、2-AG)、植物来源大麻素(四氢大麻酚THC、大麻二酚CBD)和合成型大麻素(Rimonabant、AM251等)可以作用于GPR55,据此GPR55被称为是除了大麻素受体CB1R和CB2R以外的非典型大麻素受体“CB3R”。近年来也有文章报道l‐α‐lysophosphatidylinositol (LPI)以及其类似物可能是GPR55的内源性配体,因此GPR55的脱孤仍存争议。GPR55在人体脑区和外周组织器官均有分布,与炎症、神经退行性疾病、癌症、代谢紊乱、骨骼发育等生理和病理过程有关,是治疗相关疾病的潜在靶点。此前,尚未有GPR55的结构信息,其配体识别和信号传导的分子机制尚不明确(图1a),阻碍了具有选择性和高效性的药物研发。
华甜课题组与合作者利用单颗粒冷冻电镜技术解析了反向激动剂ONO-9710531(ONO PHARMA提供)结合的GPR55非激活态结构,在分子水平揭示了GPR55的配体识别机制。分析发现ONO-9710531的结合口袋位置与已报道的class A家族拮抗剂、反向激动剂及负向别构调控分子的结合口袋位置均不相同(图1b-e)。此外,团队还解析了无配体结合的GPR55-G13(apo-GPR55-G13)复合物三维结构。与非激活态结构(GPR55-ONO-9710531)的比对发现,GPR55从非激活态到激活态,不同于经典class A激活时TM5和TM6发生明显的偏转和位移,其胞外ECL2、胞内TM7和胞内Helix8发生明显的构象变化(图1f-h)。
综上所述,本研究通过结构分析和功能研究,从分子水平揭示了GPR55特有的配体识别模式和激活机制,为靶向GPR55的配体设计和相关疾病的药物研发指明了方向。
上海科技大学iHuman研究所/生命科学与技术学院2022级博士研究生常浩、iHuman研究所副研究员李潇婷和助理研究员沈灵为共同第一作者;南加州大学化学系教授Vadim Cherezov和上海科技大学iHuman研究所研究员、生命学院助理教授华甜为该工作的共同通讯作者。上海科技大学为第一完成单位。
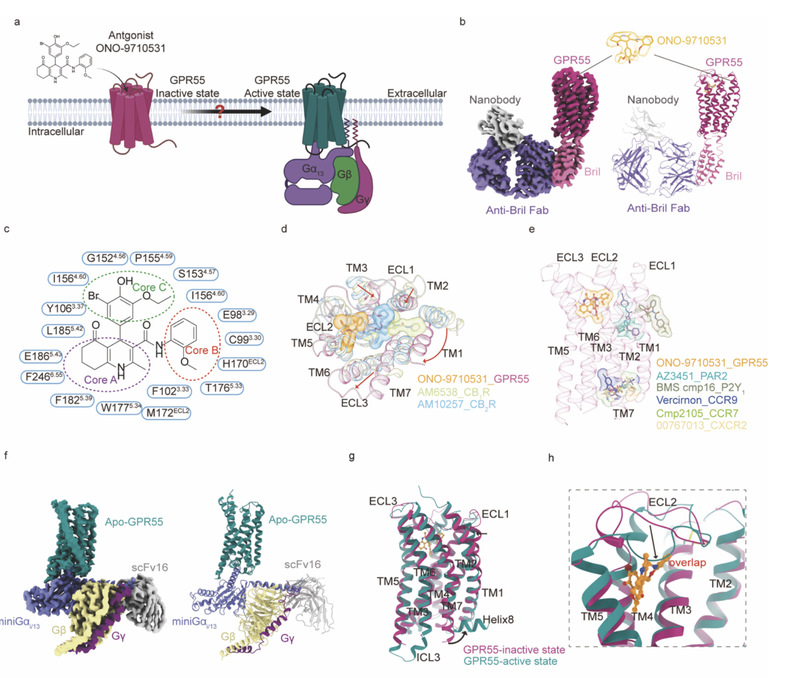
图1. apo-GPR55-G13和反向激动剂ONO-9710531结合的GPR55复合物的冷冻电镜结构。a由反向激动剂调节以及与G13蛋白偶联的GPR55的卡通展示。bONO-9710531结合的GPR55复合物的密度图和模型。cONO-9710531与GPR55相互作用示意图。紫色圆圈中的六氢喹啉基团称为“Core A”,红色圆圈中的2-甲氧基基团称为“Core B”,绿色圆圈中的3-溴-5-乙氧基-4-羟基苯基称为“Core C”。d ONO-9710531与AM6538在CB1R (PDB 5TGZ)和AM10257在CB2R (PDB 5ZTY)结合位置的比对展示图。e ONO-9710531与已解析A类GPCR中拮抗剂或负变构调节剂(NAM)结合位置的对比展示图。f apo-GPR55-G13复合体的密度图和模型。g-h apo-GPR55-G13复合物与ONO-9710531结合的GPR55复合物受体比对的整体图(g)和ECL2结构域(h)。


