近期,上海科技大学iHuman研究所徐菲课题组在新兴药物靶点G蛋白偶联受体(G protein-coupled receptor, GPCR)研究领域再传捷报,成功解析了多发性骨髓瘤重磅靶点GPRC5D、肠道炎症新靶点GPR15以及神经精神疾病新靶点TAAR1复合物的高分辨率三维结构,阐明了三类靶点识别配体或药物分子的分子机制。相关研究成果先后在线发表于国际学术期刊《自然-通讯》(Nature Communications)、《细胞发现》(Cell Discovery)和《细胞报告》(Cell Reports),为相关疾病的新药研发提供了深刻见解。



解码GPRC5D:多发性骨髓瘤抗体药物作用机制的新见解
GPRC5D属于特殊的C家族孤儿受体,其N端仅有20多个氨基酸。作为多发性骨髓瘤的新兴治疗靶点,GPRC5D近年来广受关注。2023年,FDA批准了首款靶向GPRC5D以及CD3的双抗talquetamab,用于多发性骨髓瘤的治疗。此外,还有数十款靶向GPRC5D的双抗、CAR-T以及其他产品处于临床试验研究阶段,显示了该靶点的巨大潜力。
徐菲团队利用冷冻电镜技术解析了GPRC5D与临床前管线中治疗性抗体的复合物结构,并发现了GPRC5D独特的二聚化结构特征。通过详细的结构分析,研究团队发现GPRC5D与抗体的结合具有广泛的相互作用界面,并证实了关键结合位点的作用,为后续高亲和力抗体的设计提供了基础。研究还证实,GPRC5D形成的同源二聚体界面位于受体的第四个跨膜螺旋上,并首次提出了GPRC5亚家族内保守的二聚体界面结构基序。该研究有助于基于结构设计新一代抗体药物或优化目前已有的抗体药物,为治疗多发性骨髓瘤提供新策略,该项成果以“The binding mechanism of an anti-multiple myeloma antibody to the human GPRC5D homodimer”为题,于6月19日在线发表于《自然-通讯》(Nature Communications)。

图1. GPRC5D与抗体复合物的结构及二聚体界面
肠道免疫新发现:GPR15与GPR15L的独特结合
GPR15属于Class A类GPCR的孤儿受体,分布于多种组织,在调节肠道免疫稳态和炎症反应方面发挥重要作用。徐菲团队利用冷冻电镜技术解析了GPR15与其内源性配体GPR15L的结构,发现GPR15L以“V”字型方式与GPR15结合,这与传统的趋化因子识别机制显著不同。研究发现,GPR15上的K2616.55,Y401.39和F2576.51,F2927.43等残基对GPR15L的识别至关重要。研究揭示了非典型趋化因子GPR15L与传统趋化因子在识别机制上的差异,也揭示了GPR15与其内源性配体相互作用的识别和激活机制。这一发现对多肽类或抗体类药物的设计具有重要的指导意义。该项成果以“Molecular recognition of the atypical chemokine-like peptide GPR15L by its cognate receptor GPR15”为题,于6月25日在线发表于《细胞发现》(Cell Discovery)。
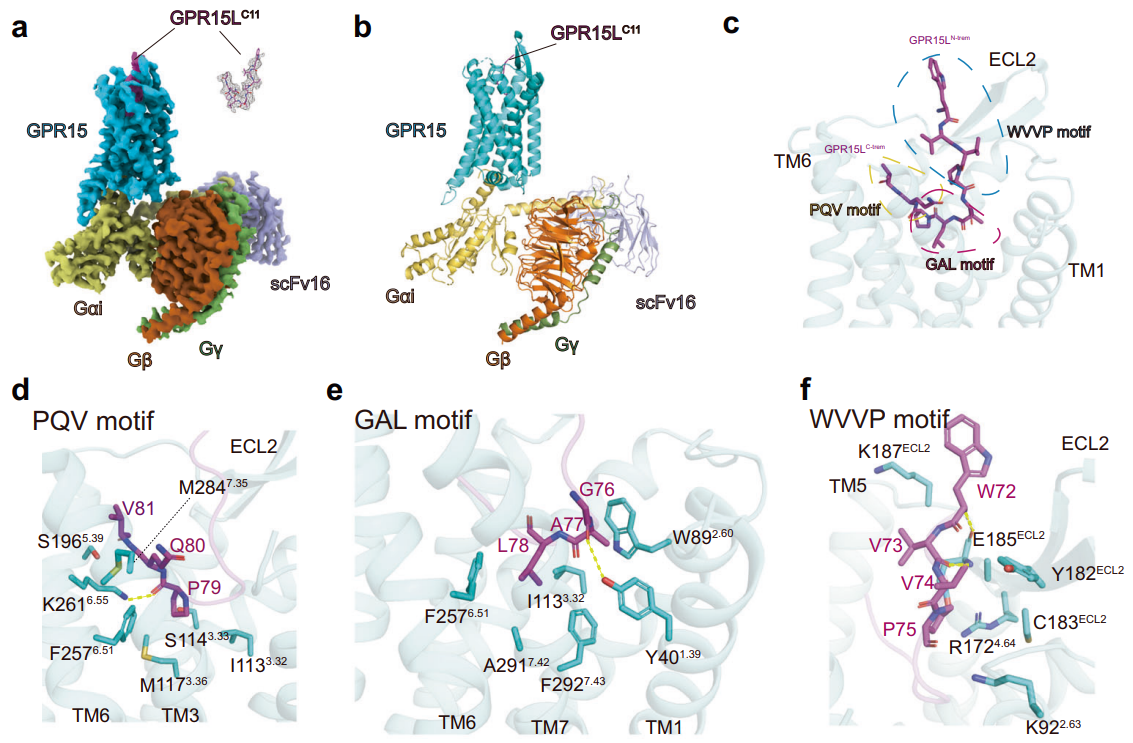
图2. GPR15L与GPR15的结合模式及相互作用界面
TAAR1研究新突破:为神经精神疾病治疗提供新视角
痕量胺相关受体1(Trace Amine-Associated Receptor 1, TAAR1)是Class A类GPCR受体,广泛分布于中枢和外周神经系统,对调节多巴胺、血清素和谷氨酸等神经递质至关重要。其功能异常与精神分裂症、抑郁、焦虑和帕金森病等多种神经精神疾病相关。作为精神疾病治疗的潜在靶点,TAAR1激动剂有望在减少副作用和成瘾治疗方面展现优势。2023年11月,徐菲团队与合作者在国际上率先报道了TAAR1与多种胺类配体结合的结构,揭示了TAAR1识别精神活性物质和药物候选分子的精细结构与激活机制,为新药开发提供了重要线索。基于此,徐菲团队联合iHuman研究所赵素文团队利用结构生物学和分子动力学模拟等方法,进一步解析了TAAR1与致幻剂LSD、部分激动剂RO5263397以及无配体状态下的高分辨率结构。研究成果于7月11日以“The Versatile Binding Landscape of TAAR1 Pocket for LSD and Other Antipsychotic Drug Molecules”为题在《细胞报告》(Cell Reports)在线发表。
研究显示,TAAR1结合LSD时展示了一个区别于5-羟色胺受体的“深度结合”模式。关键残基F186和D103周围氢键网络构成了TAAR1的独特识别和激活机制的结构基础。TAAR1的这些特性不仅为药物设计提供了分子细节,也为理解其多功能性及开发新的TAAR1调节剂提供了新见解。随着对TAAR1结合特性的深入研究,这些发现有望推动神经精神疾病的药物治疗取得突破性进展。
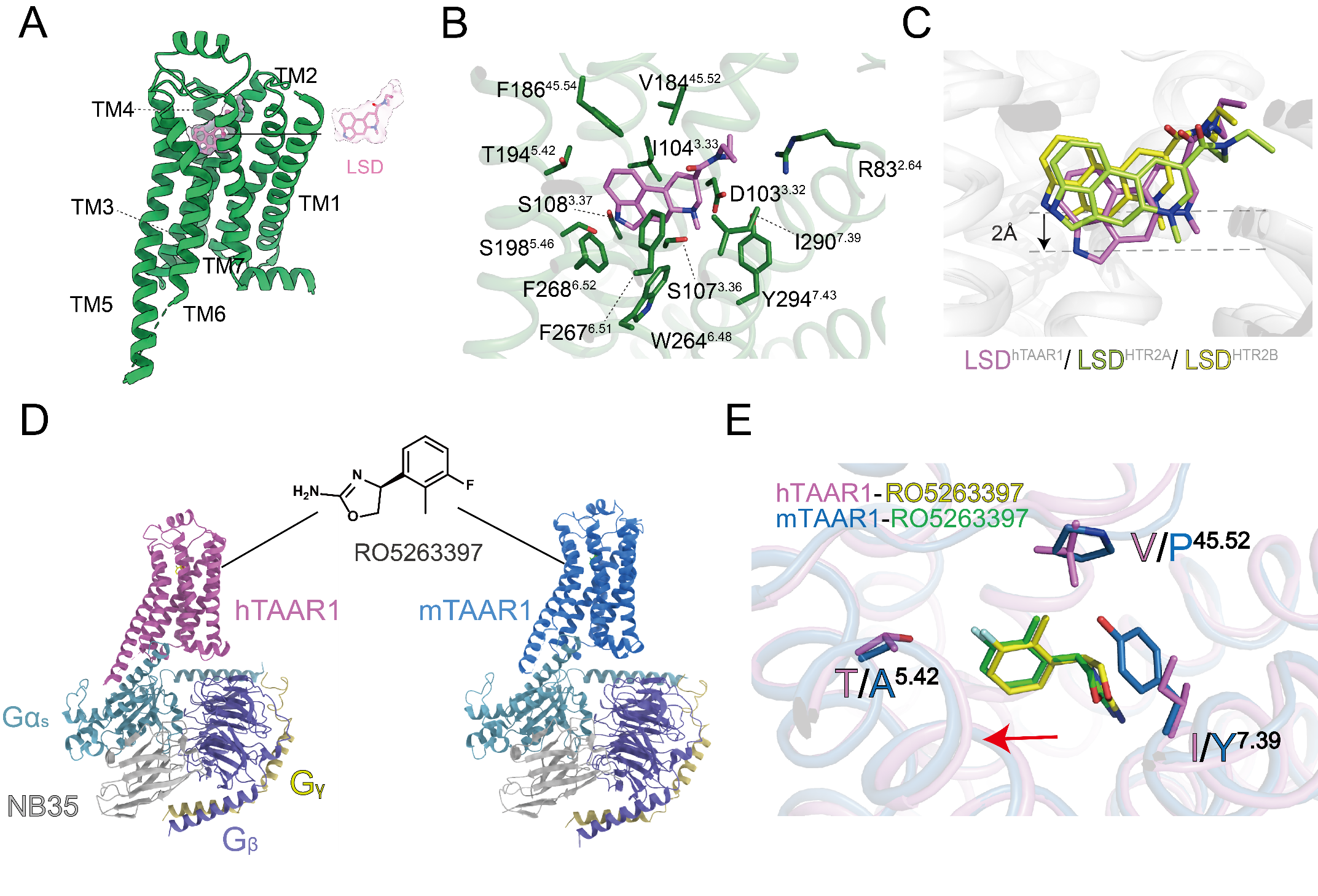
图3. TAAR1与不同配体的结合模式及相互作用界面
以上三项工作均得到上海科技大学生物电镜平台和相关技术平台的支持。GPRC5D的工作中,上海科技大学生命科学与技术学院2021级硕士研究生严鹏飞,iHuman研究所副研究员林浠为共同第一作者;GPR15研究中,生命学院2023级博士研究生张忠原和iHuman研究所博士后郑优为共同第一作者;TAAR1工作中,生命学院2021级博士研究生姜可新,iHuman研究所博士后郑优以及2022级博士研究生曾丽婷为共同第一作者,iHuman研究所研究员、生命学院常任副教授赵素文为共同通讯作者。上海科技大学iHuman研究所研究员、生命学院常任教授徐菲为三篇论文的主要通讯作者。上海科技大学为以上三篇研究论文的第一完成单位。
论文链接:
1. https://www.nature.com/articles/s41467-024-49625-y
2. https://www.nature.com/articles/s41421-024-00698-5
3. https://www.cell.com/cell-reports/fulltext/S2211-1247(24)00834-9


