近日,iHuman研究所水雯箐课题组和安德烈·萨利课题组合作,在ACS Central Science 发表了题为 “Conformational dynamics of the activated GLP-1 receptor-Gs complex revealed by cross-linking mass spectrometry and integrative structure modeling”的研究论文,通过结合化学交联质谱与整合结构建模技术,研究激活态GPCR与G蛋白复合物的构象多样性,发现了一系列区别于冷冻电镜结构的可能的非经典功能态构象。
虽然学界普遍认为G蛋白偶联受体(GPCR)在溶液中或细胞内存在多种构象,且不同构象易于相互转换,但利用常规结构研究手段往往仅可解析一种或少数几种稳定性最高的构象,而缺乏结构动态性信息极大限制了人们对GPCR激活与信号转导机制的全面理解。本研究首先利用化学交联质谱技术对激活的胰高血糖素样肽1受体(Glucagon-like peptide 1 receptor, GLP-1R)与G蛋白复合物绘制交联位点图谱,获得了该复合物在溶液中的位点空间连接信息。进一步基于整合建模平台(https://integrativemodeling.org) 将交联图谱数据转换为评分函数,并使用蒙特卡洛搜索获得了GLP-1R与G蛋白复合物的30,000个整合结构模型。
与该复合物的冷冻电镜结构相比,这一整合结构模型群体展现出显著不同的特征,结构差异主要存在于受体与G蛋白相互作用界面与G蛋白异源三聚体内部,反映出溶液中该复合物高度的构象多样性。研究团队验证了仅在整合结构模型中观测到的24对受体与G蛋白的互作位点对,在这些互作界面上位点的突变能够显著削弱受体介导的细胞信号转导,此结果支持了区别于电镜结构的复合物功能态构象的存在(图1)。本工作将为不同种类GPCR的构象动态性研究提供新思路与新方法,从而推动基于GPCR非经典构象的药物设计。
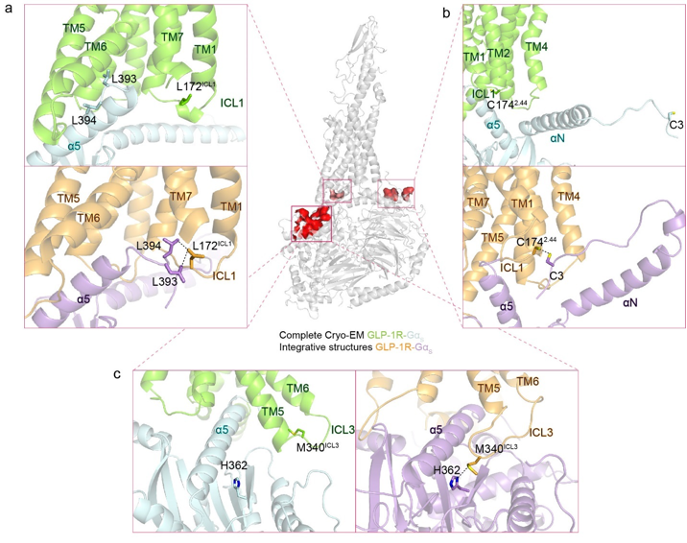
图1. 整合结构模型与冷冻电镜结构中若干功能性互作位点构象的比较

图2. 期刊网页封面设计图(由Julie Liu设计)
上海科技大学iHuman研究所研究员、生命学院常任副教授水雯箐与iHuman研究所副研究员孙立萍为该工作的共同通讯作者。生命学院2020级研究生袁诗嘉、2019级博士研究生夏丽莎与2021级博士研究生王晨汐为共同第一作者。安德烈·萨利教授、Raymond Stevens教授与北京大学雷晓光教授均为本研究合作者。上海科技大学为第一完成单位。
论文链接:https://pubs.acs.org/doi/10.1021/acscentsci.3c00063


