近日,上海科技大学iHuman研究所华甜/刘志杰团队与合作者在国际学术期刊《自然•通讯》(Nature Communications)上发表了题为“Structural basis of selective cannabinoid CB2 receptor activation”的研究论文,揭示了大麻素受体CB2 (cannabinoid receptor 2)与不同选择性激动剂配体的复合物三维结构,在分子水平阐述了配体的选择性机制,新设计的LEI-102配体能够减弱由CB2引起的肾炎症和肾损伤,并且不会非特异性激活CB1而引起的中枢神经系统副作用。本研究为靶向CB2的药物设计提供了精准模版和理论指导。
人体内源性大麻素系统参与调控多种生理功能,主要有CB1和CB2两个受体。CB1主要在中枢神经系统(central nervous system, CNS)高表达,而CB2则广泛分布在外周免疫系统,在中枢神经系统的小胶质细胞也有表达。CB2被认为是治疗炎症和免疫类疾病的理想靶点,其激动剂可以用于缓解炎痛和神经性疼痛以及神经退行性疾病等的治疗。但目前针对CB2的激动剂选择性差,通常会非特异性激活CB1而引起CNS副作用。迄今为止并没有靶向CB2受体的相关药物成功上市。
华甜/刘志杰团队长期聚焦大麻素受体CB1和CB2的结构药理学研究,在前期的工作中系统分析并揭示了CB1和CB2分别与拮抗剂、非选择性激动剂、以及下游G蛋白复合物等的高分辨率结构及配体的调控机理,相关研究成果发表在Cell(2016,2019,2020),Nature(2017)和Journal of the American Chemical Society(2021)上。
为进一步揭示激动剂对CB1和CB2受体选择性的分子基础,本研究设计并合成新型CB2选择性激动剂LEI-102,同时对已进入临床试验的CB2选择性激动剂APD371、对CB2具有高选择性的大麻素类激动剂HU308和一个CB1/CB2非选择性激动剂CP55940小分子进行研究。利用单颗粒冷冻电镜技术解析了CB2与上述小分子及Gi蛋白的复合物结构(图1)。通过结构分析和细胞水平功能实验揭示了选择性激动剂激活CB2受体的关键氨基酸位点,发现不同激动剂的理化性质会影响其进入受体的途径:高亲脂性配体(HU308和内源性大麻素)可以通过跨膜螺旋TM1和TM7之间的通道进入正构结合口袋,而极性更强的配体如LEI-102、APD371和CP55940则需要通过其他途径进入。配体进入途径过程中的氨基酸也可能实现对两个受体的选择性。新设计的CB2选择性激动剂LEI-102,具有良好的理化性质。因此,研究团队使用Cisplatin引起的肾病模型小鼠进一步探究LEI-102在其中的保护作用。研究表明,LEI-102可通过口服有效缓解肾炎和肾损伤,并且不会引起CB1介导的精神副作用(图2),表明CB2激动剂在肾脏炎症等的治疗中具有潜在的应用价值。
上海科技大学iHuman研究所副研究员李潇婷、生命学院2022级博士研究生常浩和荷兰莱顿大学药物研究学术中心Jara Bouma为共同第一作者;上科大大道书院院长、iHuman研究所执行所长、生命学院教授刘志杰,美国国立卫生研究院/国家酒精滥用和酒精中毒研究所教授 Pal Pacher,莱顿大学化学研究所教授Mario van der Stelt,莱顿大学药物研究学术中心教授Laura H. Heitman及iHuman研究所研究员、生命学院助理教授华甜为该工作的共同通讯作者。该工作得到上科大生物电镜平台和其他平台的支持,上海科技大学为第一完成单位。
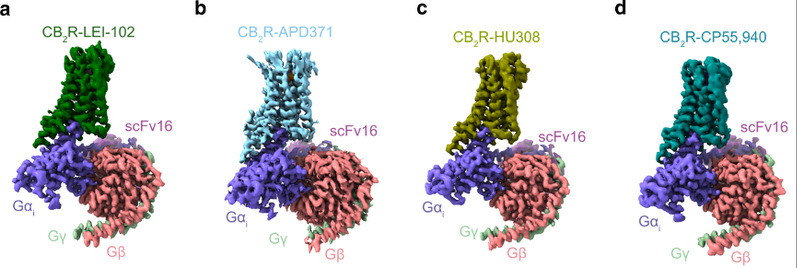
图1:CB2与不同配体及下游G蛋白复合物的三维精细结构
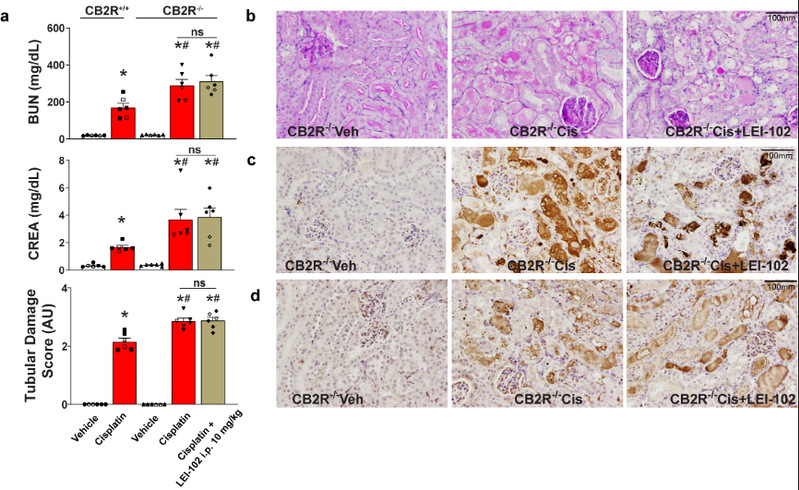
图2: LEI-102在Cisplatin引起的肾病模型小鼠中的保护作用
论文链接:https://www.nature.com/articles/s41467-023-37112-9


