近日,上海科技大学iHuman研究所水雯箐课题组和上海交通大学董佳家课题组及美国Scripps研究所Barry Sharpless课题组合作,在国际学术期刊《美国国家科学院院刊》(Proceedings of the National Academy of the Sciences, PNAS)发表了题为 “Affinity Selection of Double-Click Triazole Libraries for Rapid Discovery of Allosteric Modulators for GLP-1 Receptor”的研究论文,通过建立点击化学与亲和质谱联用技术,设计、合成并筛选模块化三氮唑分子库,发现了一组靶向胰高血糖素样肽-1受体的新型别构调控剂。
胰高血糖素样肽-1受体(GLP-1R))属于G蛋白偶联受体(G protein-coupled receptor, GPCR)家族,是治疗II型糖尿病和肥胖症的明星靶标。其天然肽激动剂的衍生物作为上市药物具有显著的降血糖、减体重的效果且副作用低,目前针对该靶标的小分子药物开发如火如荼,竞争激烈。为挖掘新的化学空间,水雯箐团队与其合作者独辟蹊径,利用双点击化学反应合成了10个结构全新的1,2,3-三氮唑库,从而对这个极具挑战的靶标开展配体筛选(图1)。
点击化学是Barry Sharpless在1999年提出的一种模块化合成理论,能够快速、高效地合成功能性分子。凭此卓越工作,K. Barry Sharpless与Morten Meldal、Carolyn Bertozzi共享2022年诺贝尔化学奖。上海交通大学转化医学研究院长聘教授董佳家在此基础上发展了“模块化的点击化合物库”构建方法,能够从廉价易得的伯胺出发,高效、可预测地合成叠氮分子库。本工作中,一名博士生以该方法独立完成了近40000个化合物的合成,然而由此产生的高容量化合物库需要与之匹配的筛选技术,尤其对于细胞筛选成本高的GPCR而言。

图1. 利用点击反应合成10个三氮唑库用于GLP1-R配体筛选
水雯箐课题组长期致力于发展高通量、定量测量蛋白质-小分子相互作用的亲和质谱技术,使之专门适用于GPCR配体筛选以及结构与功能研究。本工作中,研究团队将亲和质谱筛选与细胞活性筛选紧密结合,从10个三氮唑库中迅速捕捉到一个富集GLP-1R配体的库,而后通过第二轮定向分子库的合成与筛选,最终发现了一系列靶向该受体的新结构正向别构调控剂。该系列配体能够提高GLP-1R在内源性多肽刺激下的活性,从而促进胰岛β细胞分泌胰岛素的功能。最后,研究团队揭示了两种新配体与受体新颖的结合模式:新配体作用于受体的胞外侧口袋,以一种类似“分子胶水”的形式来增强结合多肽配体的受体活性(图2)。总体而言,本工作证明亲和质谱与模块化点击化合物库构建方法相结合,可极大提高配体筛选的化学空间的独特性和多样性,为GPCR药靶的调控剂设计与发现开辟了一条新路线。
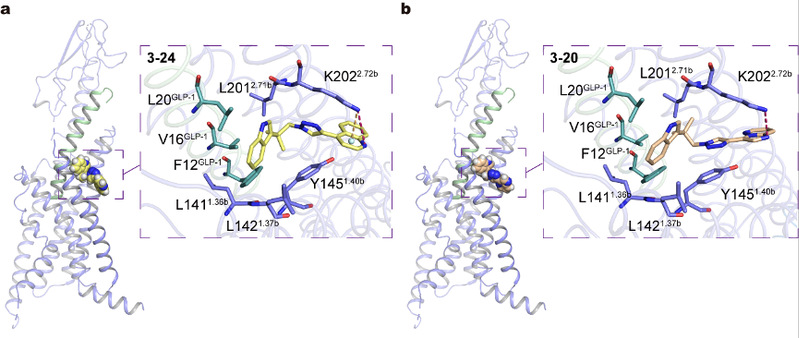
图2. 新配体3-24和3-20与GLP-1R的可能结合模式
上海科技大学iHuman研究所研究员、生命学院常任副教授水雯箐,上海交通大学转化医学研究院长聘教授董佳家,2001年及2022年诺贝尔化学奖得主、美国Scripps研究所教授巴里·夏普利斯(Barry Sharpless)为该工作的共同通讯作者。生命学院2019级博士研究生辛晔、上海交通大学研究生刘硕、iHuman研究所副研究员刘艳为共同第一作者。该工作得到iHuman研究所创始所长Raymond Stevens的大力支持,上海科技大学为第一完成单位。
文章链接:https://www.pnas.org/doi/10.1073/pnas.2220767120


