随着冷冻电镜技术在膜蛋白结构研究领域的飞速发展,复杂的多态膜蛋白复合物结构功能研究成为可能。上海科技大学iHuman研究所徐菲团队利用冷冻电镜技术首次解析了心血管疾病重要药物靶点APJ受体(一种A类G蛋白偶联受体)分别以2:1和1:1的化学计量比与下游G蛋白形成活性复合物的三维结构,并揭示了APJ受内源性多肽或小分子激动剂调控的多重机制。 G蛋白偶联受体(G protein-coupled receptor, GPCR)是目前最大的药物靶标超家族,在细胞信号转导中发挥着重要作用。其中,A类G蛋白偶联受体是GPCR超家族中最大的家族,也是目前研究最多的GPCR家族。该研究突破性地揭示了第一个以二聚体形式介导信号传导模式的A类GPCR成员。7月11日,该成果在线发表于国际学术期刊《自然·结构与分子生物学》(Nature Structural & Molecular Biology)。
APJ受体与心脏发育、心血管稳态和心脏收缩密切相关,是近年来最引人关注的心血管疾病药物新靶点之一。APJ受体信号通路的激活可以缓解或治疗心脏衰竭、高血压等疾病。APJ的内源性配体包括Apelin和Elabela两类多肽,在心脏发育和心血管调节中发挥不同的作用。其中,Elabela是近几年新发现的内源性多肽配体,母体在胎儿发育期间缺乏Elabela会导致发育中胎儿先兆子痫和心血管畸形。多家国际知名药企如安进、赛诺菲等都在尝试开发有效的APJ激动剂配体类药物,但至今仍未有新药上市。为了开发APJ新型激动剂类药物尤其是小分子药物,需要解决APJ受体是如何被配体激活,小分子配体结合受体的分子机制是什么,两类内源性多肽配体的作用机制分别是什么,以及信号通路调控新机制尤其是受体二聚化的结构基础是什么等关键科学问题。为了回答这些问题,徐菲课题组从2014年起即展开了对APJ受体的结构与功能研究,并取得了一系列突破性的成果。团队于2017年在Cell子刊Structure上率先报道了APJ受体与Apelin类似物的复合物结构,揭示了受体识别多肽配体的 “双位点”模式。然而关于APJ如何识别Elabela类内源性配体以及小分子配体的机制尚待阐明,受体激活机制仍然不清楚,限制了靶向APJ的新型配体药物的研发。另一方面,A家族GPCR的新调节机制,如二聚化,是长期以来备受关注的焦点问题。尽管有一系列功能实验的支持,精准的二聚体结构的缺乏使得分子机制以及二聚化与受体信号转导的关系无法明确。
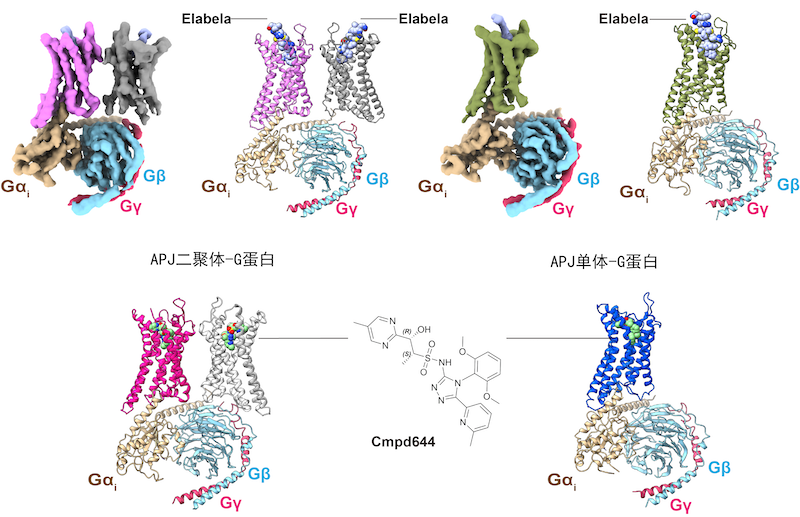
图1 APJ受体二聚体和单体与内源性多肽Elabela/小分子cmpd644及下游G蛋白复合物的三维精细结构
为了进一步解答上述科学问题,徐菲团队经过多年的持续探索,在上海科技大学生物电镜平台以及上海交通大学分析测试中心的支持下,借助冷冻电镜技术,成功揭示了内源性配体Elabela和高亲和力小分子化合物cmpd644(与用于治疗心力衰竭的临床阶段候选药物具有类似结构)的结合模式,同时也首次获得了APJ受体激活状态下的结构(图1)。
令人欣喜的是,研究团队在对同一种复合物样品进行冷冻电镜二维分类时,还获得了APJ二聚体和单体与下游G蛋白结合的两种复合物结构,该结构显示APJ二聚体和单体均只与一个G蛋白结合(图1)。此外,该研究发现, APJ(A类GPCR)的二聚体是通过一个非常小的疏水界面连接(图2),这种有限的相互作用界面与A类GPCR的单体-二聚体灵活可塑性相关,同时也意味着A类GPCR二聚体的形成可以不需要广泛的相互作用,这可能与相关药理学调控相关。这些发现共同揭示了GPCR通过二聚体及单体发挥作用的多种调节机制,为后续的GPCR同源及异源二聚化研究开辟了新的思路,为APJ受体双重内源性配体的识别机制及后续研究提供了重要的结构基础,也为基于结构的高选择性靶向药物开发提供了精准模板和崭新的作用机制。
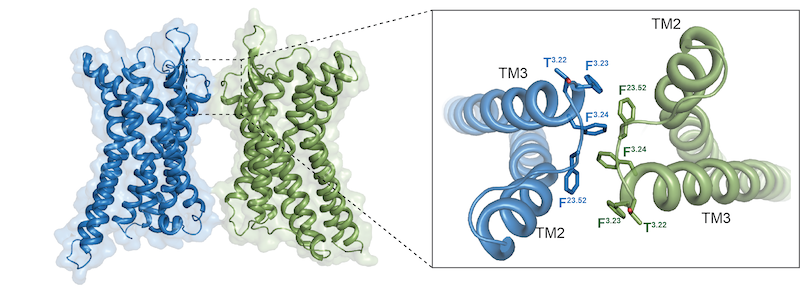
图2 APJ受体形成二聚体的界面图
该研究成果论文题为“Structural insight into Apelin Receptor-G Protein Stoichiometry”。上海科技大学iHuman研究所科研助理岳洋、生命学院2021级博士研究生刘立尔以及iHuman研究所副研究员武丽杰为文章共同第一作者,上海科技大学iHuman研究所研究员、生命学院常任副教授徐菲为文章通讯作者。上海科技大学为论文的第一完成单位。

从左到右依次为:岳洋,刘立尔,武丽杰,徐菲


