电压门控钾通道(Voltage-gated potassium channel,Kv)促进钾离子在动作电位复极化阶段流出细胞,从而调节神经元和心肌等可兴奋细胞的膜电位,对神经系统和心脏等正常功能的维持发挥着至关重要的作用。人源电压门控钾通道包括12个亚家族(Kv1-Kv12),其中KCNQ通道蛋白属于其第7个亚家族(Kv7) ,具有重要生理和病理功能。 KCNQ通道蛋白的功能紊乱可导致癫痫、耳聋、神经发育紊乱、智力障碍等疾病。KCNQ通道蛋白的激动剂或抑制剂具有治疗相关疾病的潜力。然而,以往的靶向KCNQ的候选药物具有一定的副作用,开发新一代有效的药物需要从新的作用机制入手。因此,KCNQ通道蛋白与内源性信号调节分子以及候选治疗配体的复合物结构研究对指导未来的基础、转化和临床研究工作具有重要意义。
近日,上海科技大学iHuman研究所徐菲团队和复旦大学舒易来团队合作在Neuron期刊在线发表了题为“Structural insights into the lipid and ligand regulation of a human neuronal KCNQ channel”的研究论文,首次解析了一个神经KCNQ通道蛋白KCNQ4在内源性脂类配体PIP2存在时的开放态构象结构,揭示了信号脂类分子PIP2调控KCNQ通道开放的分子机制,为基于结构的靶向药物设计和优化提供了精准模板。

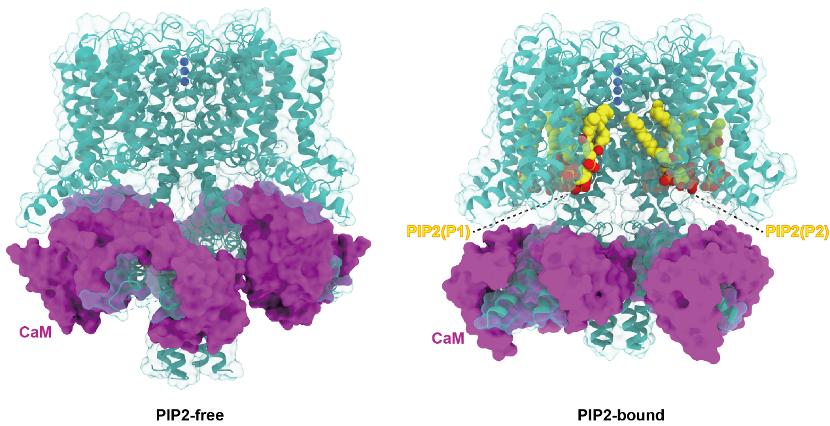
KCNQ通道的开放依赖于信号脂类分子PIP2。 然而,PIP2调节神经KCNQ通道开放的分子机制仍不清楚。研究团队通过将纯化的KCNQ4通道蛋白重新组装成更加接近天然膜环境的纳米盘,从而在类膜环境中成功引入脂类分子PIP2, 获得了PIP2结合的KCNQ4通道开放态构象。在上海科技大学生物电镜平台的技术支持下,研究团队利用冷冻电镜三维重构技术获得了KCNQ4在PIP2-free 和PIP2-bound两种状态的高分辨结构。首次通过结构生物学的方法证实了KCNQ通道存在两个不同的PIP2结合位点。通过结构比对分析可以发现,PIP2的结合导致了KCNQ4胞内域和CaM发生了较大尺度的构象重排,两个PIP2分子以一种协同作用的方式偶联了通道的电压感受域(VSD)和通道孔域(PD),从而介导了通道的开放。通过同源序列比对,研究人员发现PIP2的结合位点在KCNQ家族非常保守,提示PIP2可能通过类似机制调控其他KCNQ通道蛋白的开放。舒易来团队通过电生理等一系列功能实验验证了这两个PIP2结合位点的工作机制。该研究阐明了PIP2调控KCNQ家族通道蛋白开放的分子机制,为开发靶向KCNQ家族蛋白的药物设计提供了新的机遇,为耳聋等神经系统疾病治疗的临床转化提供了科学依据。
上海科技大学生命学院2020级博士生郑优、2017级博士生刘恒、2020届博士毕业生董少伟,以及复旦大学附属眼耳鼻喉科医院博士后陈玉鑫为该论文的共同第一作者;复旦大学附属眼耳鼻喉科医院研究员舒易来,上海科技大学iHuman研究所、生命学院副教授徐菲为共同通讯作者。上海科技大学为论文的第一完成单位。该工作得到了科技部国家重点研发计划、国家自然科学基金、上海市科委等项目的资助。
论文链接:https://doi.org/10.1016/j.neuron.2021.10.029


