G蛋白偶联受体(GPCRs)在细胞信号转导中意义重大,是很多药物的重要靶标。大麻素I 型受体(CB1)是中枢神经系统中表达最丰富的GPCR之一,在调节学习认知、能量平衡、疼痛、成瘾、神经保护等生理及病理过程中发挥着重要作用。然而,目前关于CB1结构与功能的研究主要集中在离体(in vitro)水平。对CB1在细胞原位(in vivo)情况下的信号转导机制的研究结果鲜有报道。
近日,上海科技大学iHuman研究所、生命科学与技术学院钟桂生课题组在学术期刊Nature Communications上发表研究论文,题为Organized cannabinoid receptor distribution in neurons revealed by super-resolution fluorescence imaging。该工作利用超高分辨率显微成像技术在活体神经元上验证了大麻素受体CB1沿轴突呈现周期性分布,并与膜相关周期骨架(MPS)密切相关,揭示CB1受到激动剂激活后提高了相关信号通路转导效率。

近年来颇受关注的超高分辨率显微成像技术不仅突破了光学成像中的衍射极限的限制,把传统成像的分辨率提高了10-20倍,达到了纳米量级的分辨率,而且这些成像手段在观察细胞内的蛋白以及其他分子的精细结构和定位中具备其它方法无法比拟的优势,为研究蛋白在细胞中的结构和功能提供了极佳的观测条件。钟桂生课题组采用受激发射损耗(STED)显微成像技术,系统地研究了CB1在脑组织和原代培养神经元中的纳米结构,发现CB1簇形成间距约190 nm的“热点”,周期性地排布在轴突上。另外,课题组还通过结合双色STED 成像及其他生化细胞技术证实CB1“热点”与MPS存在相互作用。
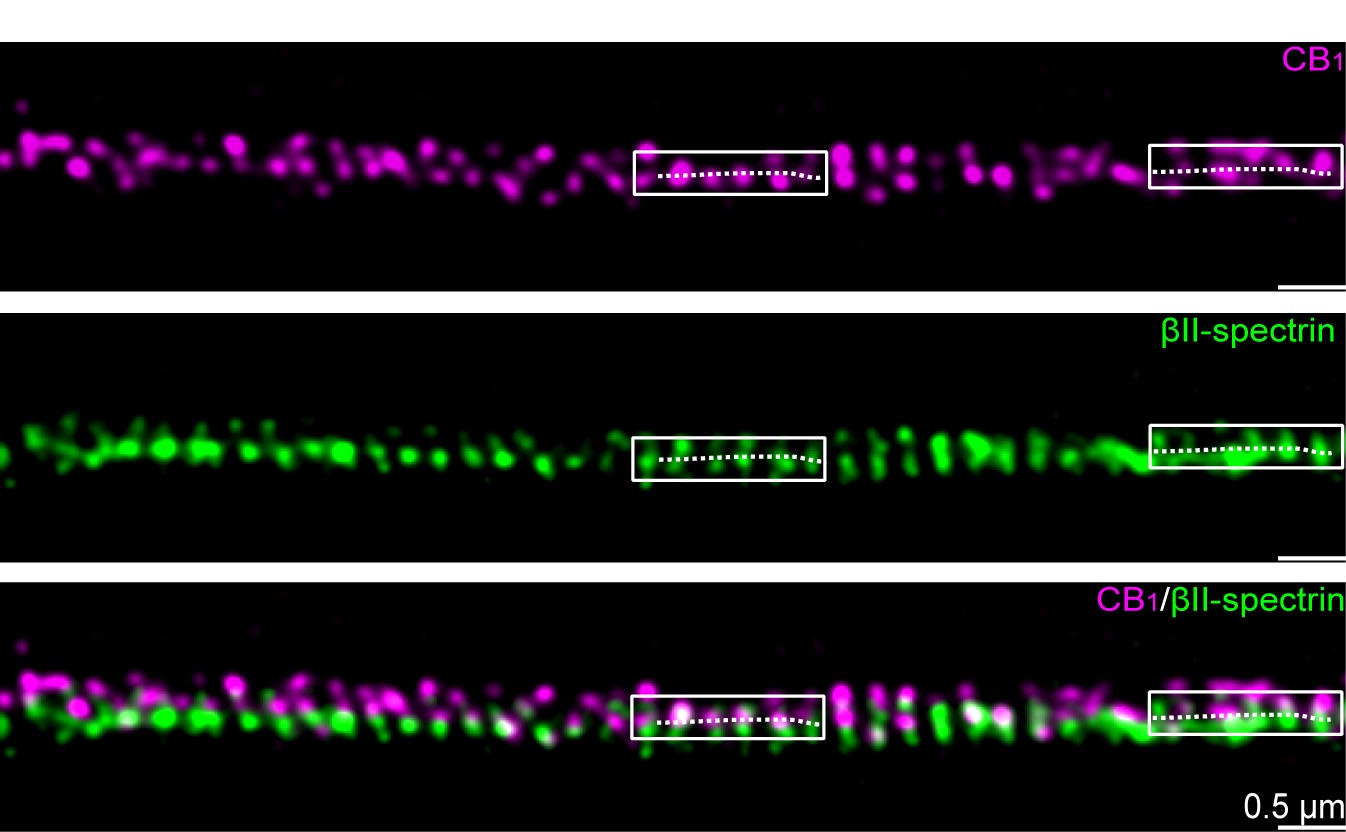
图1 CB1与MPS共定位
基于上述发现,研究人员采用另一种超高分辨率显微成像技术——结构照明显微镜(SIM)深入探究了在活体神经元中CB1周期性构域的特点及功能意义。令人振奋的是,研究发现在活体神经元中CB1“热点”仍呈现周期性分布规律,并在加入CB1激动剂后,CB1周期性“热点”表现出动力学受限,运动及流动性降低。这表明,CB1可能通过ankB锚定在MPS上,通过形成一些基本的结构单元来快速应答细胞外刺激。研究人员还进一步证明了CB1下游Erk和AKT信号通路的激活需要MPS参与。
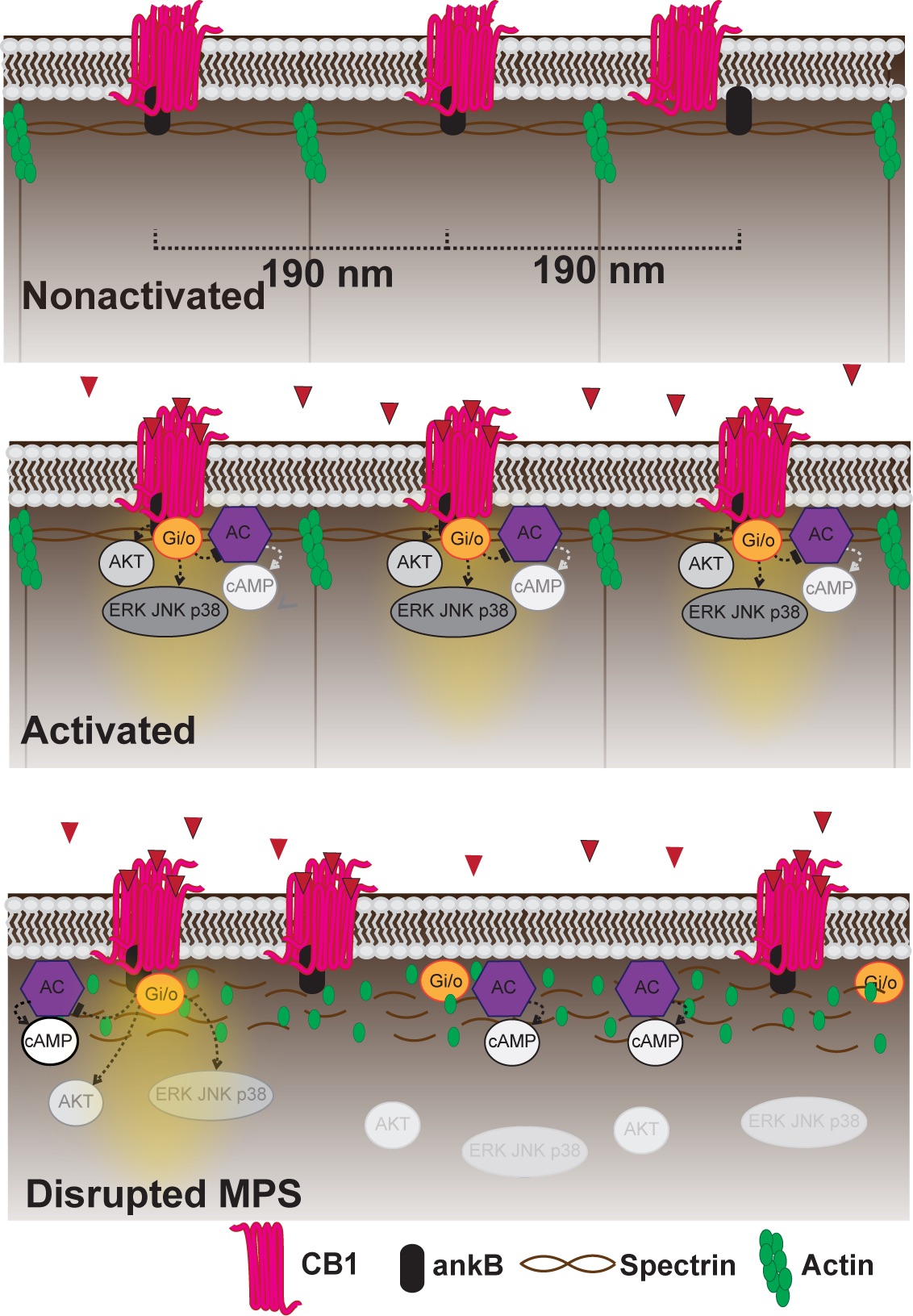
图2 CB1动态形成周期性”热点“簇来提高下游信号转导效率的示意图
该研究利用超高分辨率显微成像技术的优势,直接观察以往无法观察到的亚细胞结构,发现了神经元轴突上周期性的CB1“热点”簇结构域,且与MPS 存在相互作用,揭示了CB1周期性结构域是参与CB1信号通路调控的关键结构,并进一步证实MPS是膜蛋白信号转导的动态调节平台。这些发现为神经元结构-功能相互作用的研究提供了一个崭新视野,也为GPCRs相关的药物研发提供了可能的新策略。
在本论文中,钟桂生课题组博士后李卉(现为Garth J. Thompson课题组助理研究员)、2018级博士生杨洁、iHuman研究所成像平台田翠萍为共同第一作者,钟桂生为本文通讯作者,上科大为第一完成单位。该研究项目得到了上海科技大学科研启动基金、科技部重大专项和国家自然科学基金委的资助。


