近期,我校iHuman研究所、生命学院水雯箐课题组受邀在Current Opinion in Biotechnology上发表了题为“Systematic Mapping of Protein-Metabolite Interactions With Mass Spectrometry-Based Techniques” 的综述,系统总结了可用于发现细胞内蛋白质-代谢小分子相互作用关联的化学蛋白质组学方法。水雯箐课题组长期从事药物靶标蛋白的配体筛选研究,尤其关注GPCR这类膜蛋白,发展质谱技术用于新结构、新功能GPCR配体的发现。此前,该课题组发展了一种迭代亲和质谱技术,可应用于GPCR靶向的小分子配体高通量筛选,相关成果于2019年7月发表于Analytical Chemistry,题为“Accelerating the Throughput of Affinity Mass Spectrometry-Based Ligand Screening toward a G Protein-Coupled Receptor”。
蛋白质和小分子代谢物之间的分子识别在调节蛋白质功能和影响各种细胞生物学过程中起着至关重要的作用。蛋白质-代谢物的相互作用(protein-metabolite interaction, PMI)可以调控代谢酶、转录因子、转运蛋白以及膜受体的活性,从而可以将细胞代谢与遗传调控、环境感知和信号转导联系起来。据推测,特定的细胞中可能存在数百万对功能相关的PMI,其复杂程度不亚于蛋白质-蛋白质相互作用(PPI)网络。而迄今为止,最全面的PMI分析只鉴定出大肠杆菌细胞内20种代谢物分子与800余种内源代谢酶与之间存在1678对互作关联,远低于哺乳动物细胞中已发现的近56000种蛋白-蛋白互作对组成的PPI网络。大规模绘制细胞内PMI关联图谱仍面临着多种技术障碍,如难以检测低亲和力和瞬时PMI,某些蛋白质无法进行体外纯化,尤其是全长跨膜蛋白质等等。
近些年来,基于质谱(mass spectrometry)的化学蛋白质组学和代谢组学技术的快速发展促进了PMI的系统性研究。综述文章全面总结了利用组学策略进行PMI研究的最新进展,讨论了不同PMI研究方法的优势和局限性,以及在质谱定量分析和数据挖掘中如何提高PMI鉴定准确性的思路(图一),为探索细胞内众多未知的蛋白质-代谢小分子相互作用及其与疾病的关联提供了可借鉴的研究策略。
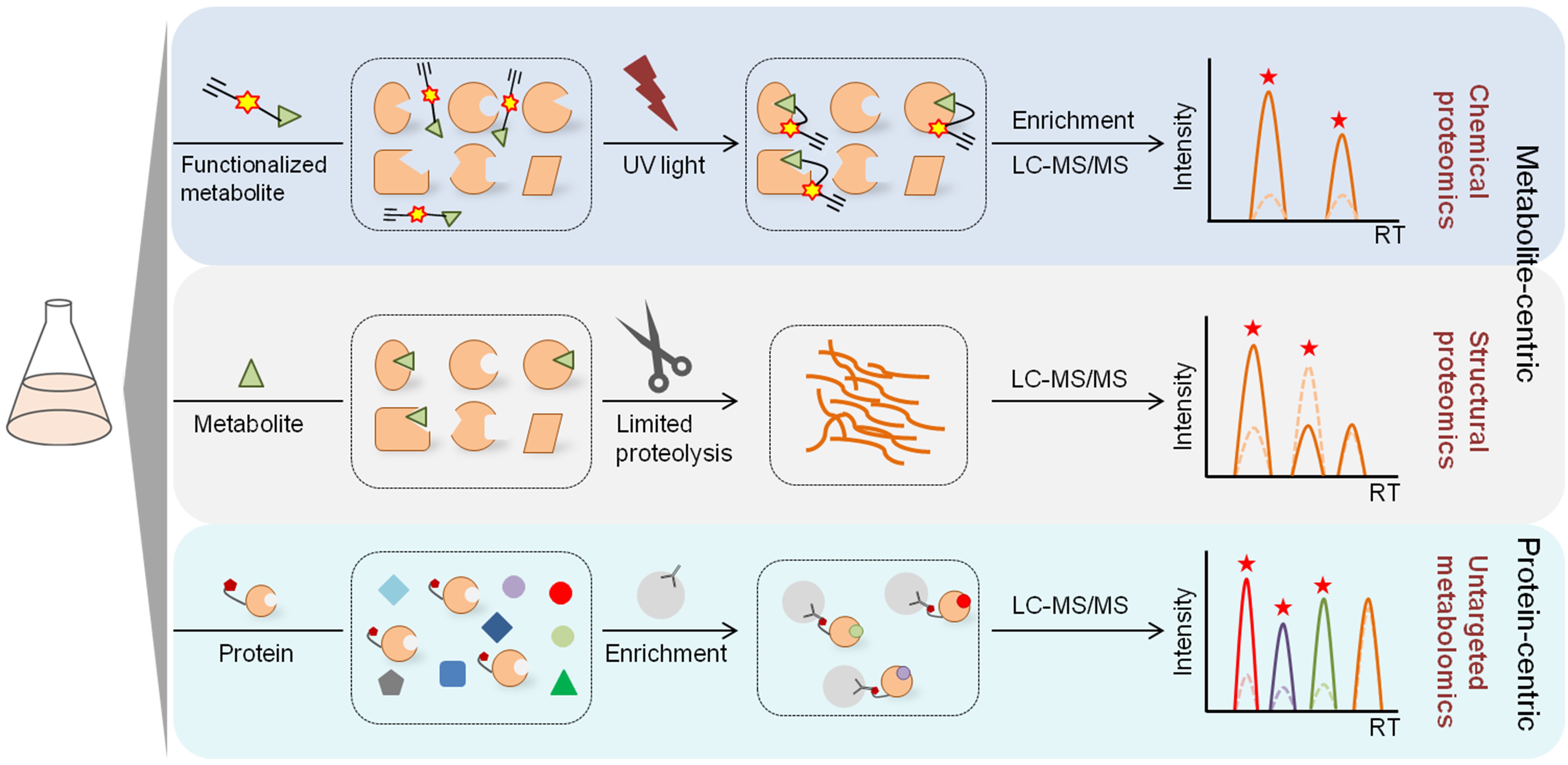
图一:以代谢物小分子或蛋白质为中心的PMI研究策略
该综述中介绍的亲和质谱技术也是从小分子混合物中快速筛选靶蛋白配体的有力工具,但是目前其通量限制在每组混合物包含400-2000个化合物,并且传统的筛选流程通常需要体外纯化靶蛋白,这对于结构稳定性低的膜蛋白来说是非常大的挑战。水雯箐课题组在已有研究基础上(Chem. Sci. 2018)进一步发展了一种新型的迭代式亲和质谱方法,此方法能够一次性从2万个化合物组成的混合物中高效富集结合特定GPCR靶标的配体,筛选出的配体亲和力通常在微摩尔以下(图二)。此外,该方法可针对纯化的GPCR蛋白或者表达GPCR蛋白的细胞膜组分进行配体筛选,而后者可省去膜蛋白纯化的繁琐步骤。作者利用这种高通量、无标记、可定量的亲和质谱技术,针对A2A 腺苷受体筛选得到三种新结构的拮抗剂。该研究论文此前发表于Analytical Chemistry期刊。
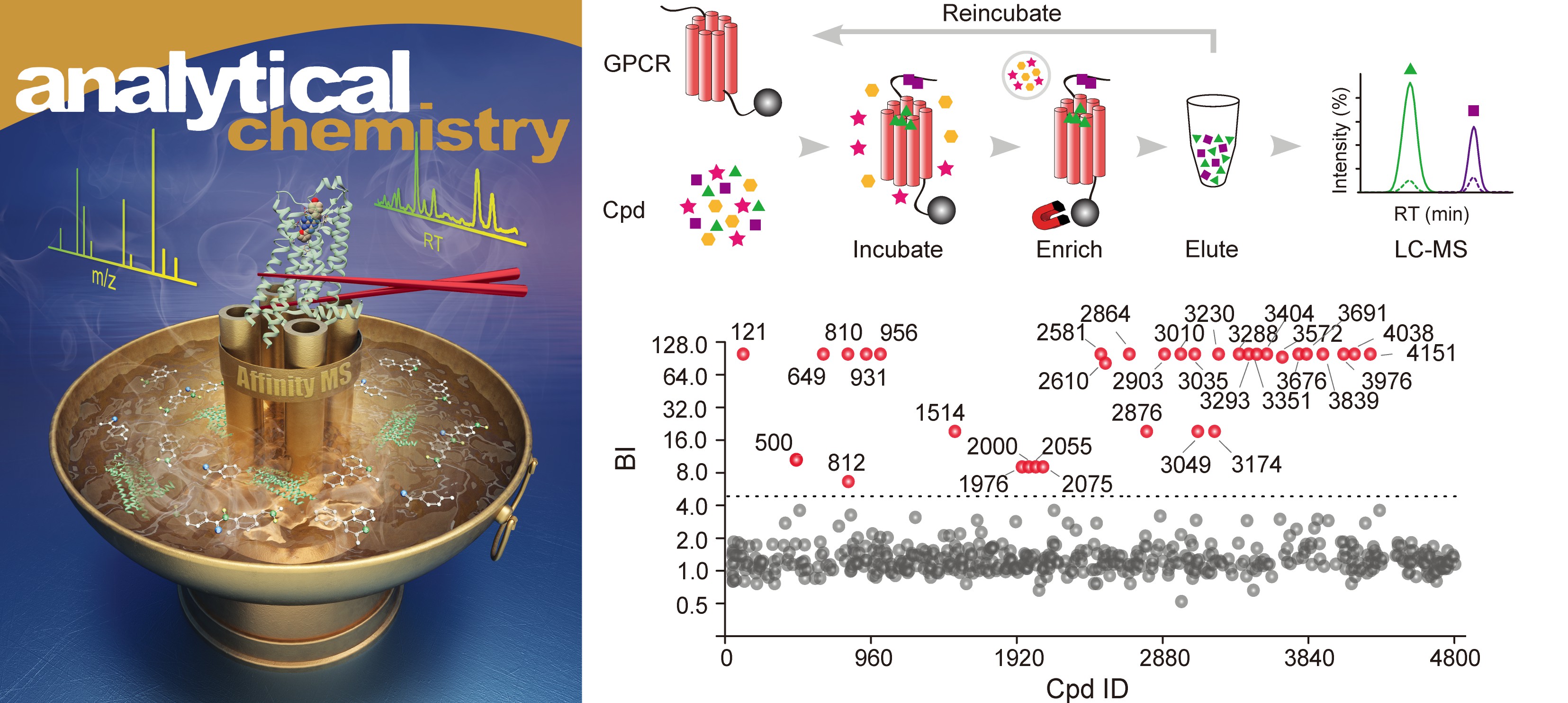
图二:迭代式亲和质谱技术提高GPCR配体筛选通量
iHuman研究所科研助理李珊珊为综述文章的一作,水雯箐研究员为通讯作者。亲和质谱技术的研究论文由水雯箐课题组博士生陆燕和研究助理秦姗姗主要完成,为共同一作,水雯箐研究员与中科院药物所王明伟研究员为共同通讯作者。两篇论文中上科大均为第一完成单位。该项目得到了上科大科研启动基金、国家重大专项和国家自然科学基金等支持。


