2019年8月19日,上海科技大学iHuman研究所/生命学院钟桂生课题组、东南大学柴人杰课题组与复旦大学附属眼耳鼻喉科医院李华伟课题组合作在《Nature Communications》在线发表了题为“AAV-ie enables safe and efficient gene transfer to inner ear cells”的最新研究成果。该研究开发出一种可用于耳聋基因治疗的AAV新变体,命名为AAV-ie (AAV-inner ear)。相较传统的血清型AAV,AAV-ie能够高效且安全地靶向小鼠内耳的各种组织细胞且在支持细胞(Supporting cell)上显示出优于其它AAV的感染率。而且,AAV-ie也能高效感染人的内耳组织细胞,表明其具有临床应用的潜力。
目前,相关研究已经鉴定出超过3000个基因的突变会导致符合孟德尔遗传的疾病[1]。基因治疗利用载体将外源正常基因或者基因编辑工具导入靶细胞,从而达到纠正基因缺陷的目的。该方法能在根源上解决基因突变所导致的疾病。腺相关病毒(AAV)以其高细胞感染性和低免疫原性成为现阶段基因治疗的理想载体。美国FDA在2017年和2019年批准了两个基于AAV载体的基因治疗药物,分别用于视网膜营养性萎缩症和脊髓性肌肉萎缩症(SMA)的治疗。截至2018年底,大约有145项AAV介导的基因治疗在进行临床试验[1]。但是,尚未有针对听力损失的AAV基因治疗进入临床,部分原因是由于缺少合适的AAV血清型。

听力损失是最常见的感官障碍之一,影响到世界6.8% 以上的人口(约5亿人)。大多数情况下,听力损失是由于耳蜗毛细胞(Hair cell)的损伤所致。耳蜗毛细胞负责感知和传递声音,而支持细胞则起到支撑毛细胞并维持微环境的作用。目前,已经有100多个耳聋基因的突变被发现[2]。大多数耳聋基因在毛细胞中表达,也有一些关键耳聋基因如GJB2 等则主要表达在支持细胞中[3]。耳蜗支持细胞能在一定条件下转分化为毛细胞。因此,靶向支持细胞的基因治疗对于修正耳聋基因以及耳蜗毛细胞的再生具有重要意义。
现阶段传统的AAV血清型已经在内耳中被广泛尝试,常见的AAV型如AAV1、AAV2、AAV6、AAV8、AAV9等均显示出对内耳各种细胞的低感染率[4]。为解决现有AAV型对内耳组织细胞感染率不高的问题,钟桂生课题组及其合作者对现有的一种AAV载体AAV-DJ进行了改造,通过在AAV-DJ的衣壳蛋白中插入一些特定的短肽得到了AAV突变体,并将这些AAV突变体包装绿色荧光蛋白mNeonGreen,然后体内注射感染小鼠耳蜗,得到了一个能高效感染Sox2阳性支持细胞(品红色)的AAV新突变体AAV-ie(图1)。结果显示,AAV-ie对支持细胞的感染率优于其他AAV血清型。同时,研究人员也对AAV-ie的安全性进行了验证,通过扫描电镜和听力测试等手段,研究人员发现AAV-ie并不影响毛细胞的形态和小鼠听力(图2)。这些结果表明AAV-ie是一个安全且高效的载体。
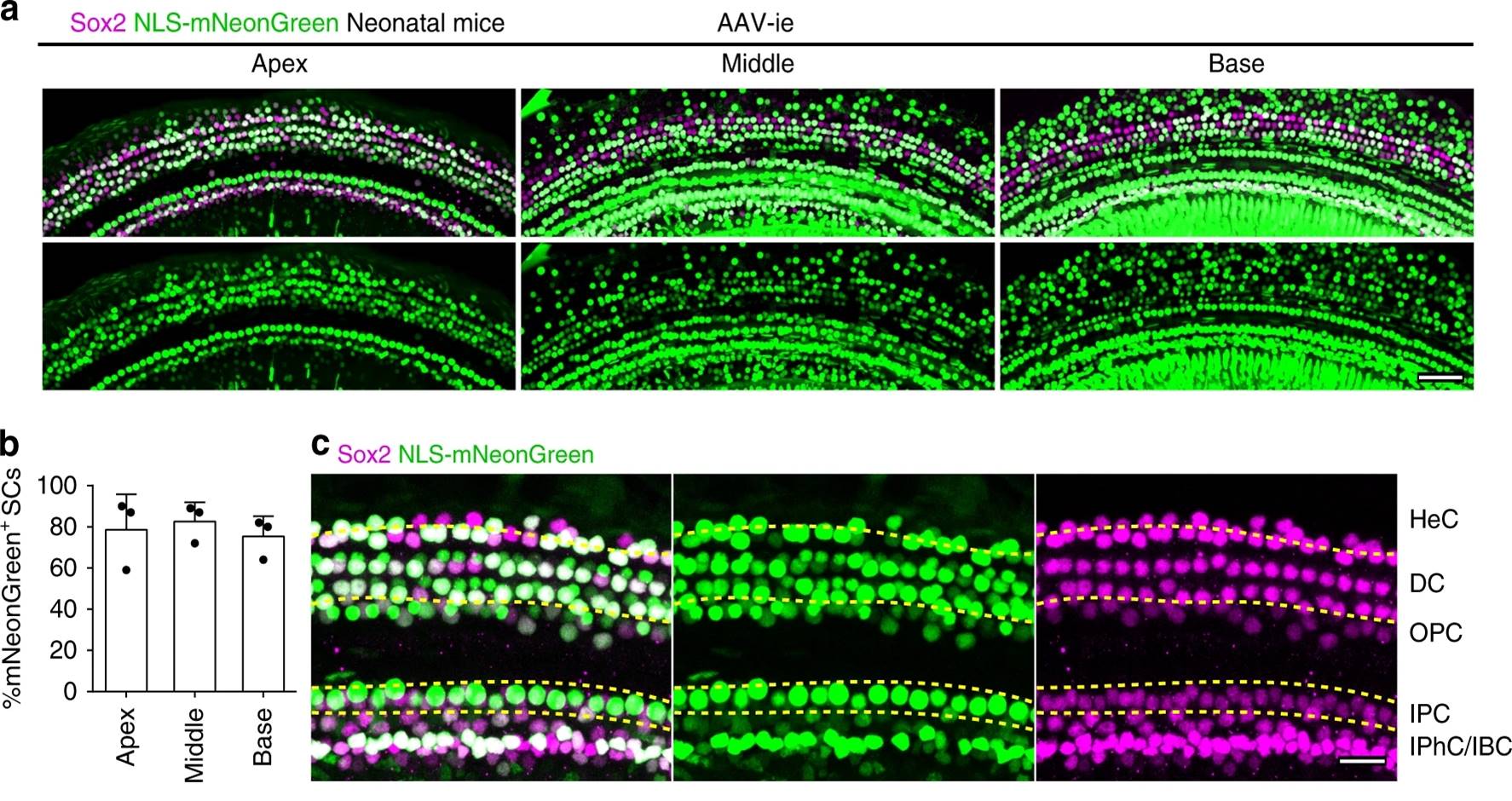
图1. AAV-ie高效感染小鼠耳蜗支持细胞
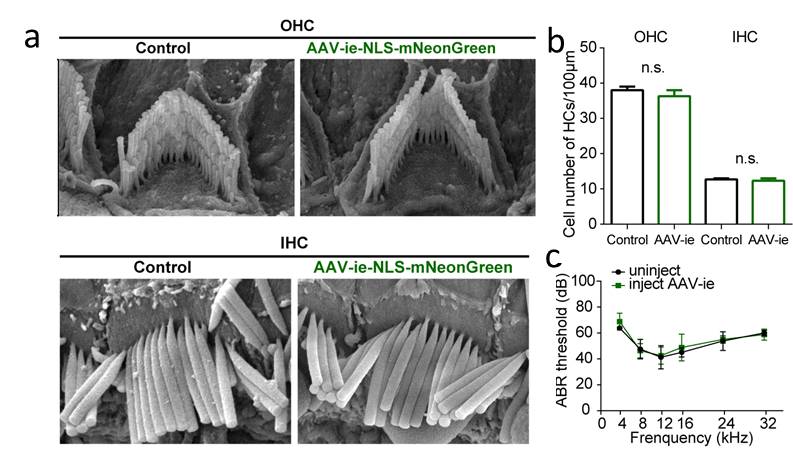
图2. AAV-ie是一个安全的病毒载体
为探索AAV-ie的临床应用的可能性,钟桂生组与复旦大学附属眼耳鼻喉科医院李华伟课题组合作,用AAV-ie-mNeonGreen感染病人的内耳组织样本。结果显示其也能高效的感染人的毛细胞和支持细胞(图3)。
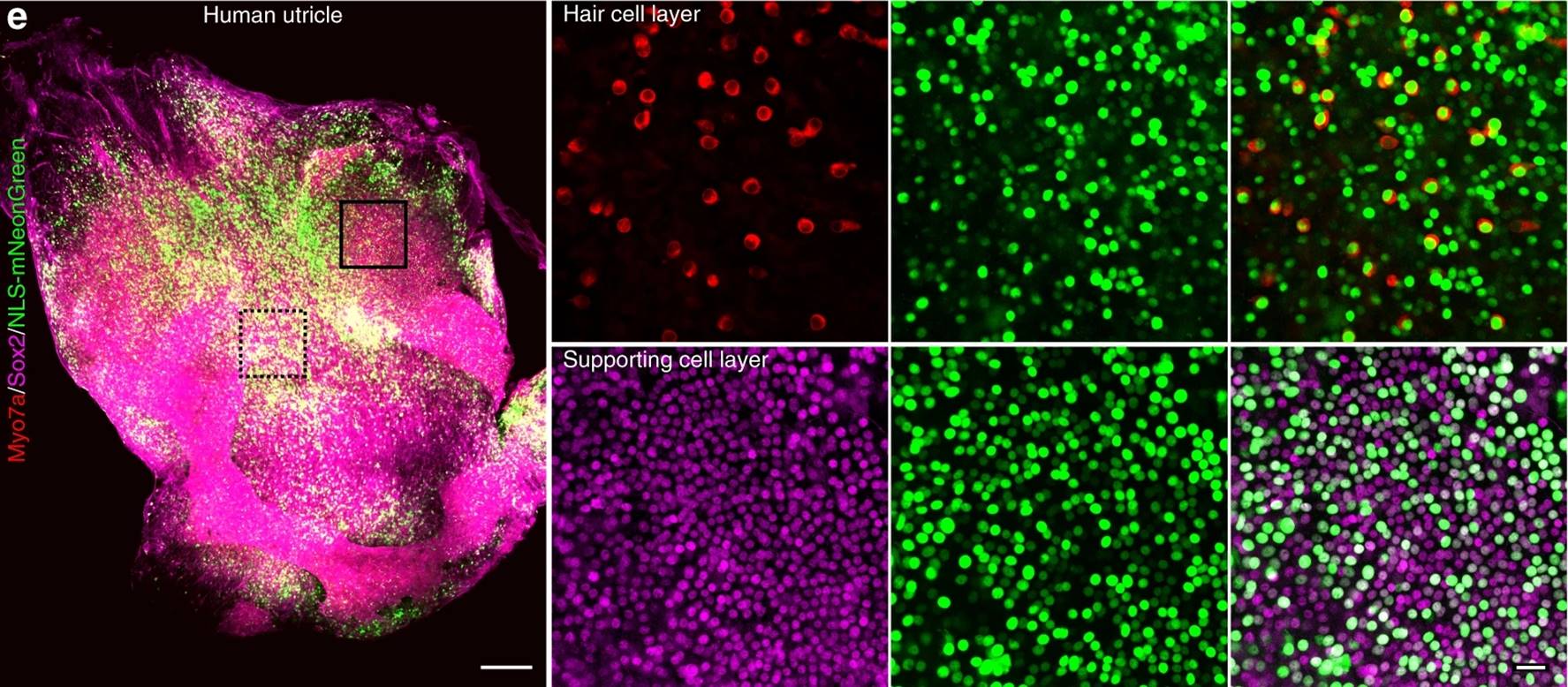
图3. AAV-ie高效感染人椭圆囊组织样本
虽然AAV-ie能高效感染耳蜗支持细胞,但其基因治疗的潜力还需验证。因此,研究人员将带有耳蜗毛细胞再生因子Atoh1的AAV-ie病毒注射入小鼠内耳,发现AAV-ie–Atoh1能大量再生Myo7a阳性(品红色)的毛细胞(图4),提示AAV-ie具有再生应用的潜能。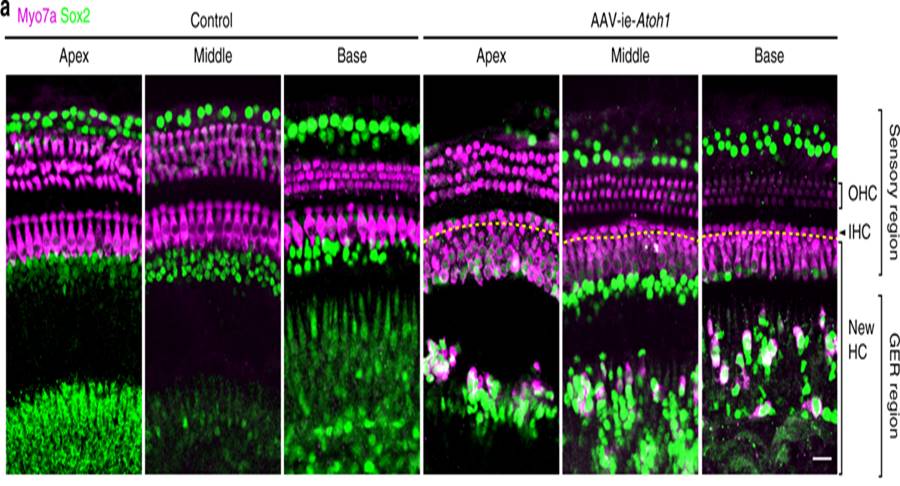
图4. AAV-ie-Atoh1促进毛细胞再生
据悉,AAV-ie是第一个在耳蜗中能高效感染支持细胞的AAV载体,该研究也首次在小鼠耳蜗中利用AAV载体实现了毛细胞再生。而且,对人样本的高感染率也显示AAV-ie可能具有临床应用价值。AAV-ie血清型以及其在基因治疗中的应用已经申请国家专利和国际专利。
本研究由上海科技大学iHuman研究所/生命学院钟桂生课题组、东南大学柴人杰课题组与复旦大学附属眼耳鼻喉科医院李华伟课题组合作完成,上科大为第一完成单位。钟桂生组的博士后谈方志、储岑凤博士、东南大学齐洁玉博士以及复旦大学附属眼耳鼻喉科医院李文妍医生为共同第一作者。钟桂生教授、柴人杰教授、李华伟教授和谈方志为共同通讯作者。
原文链接:https://www.nature.com/articles/s41467-019-11687-8
参考文献
1. Wang, D., Tai, P.W.L. & Gao, G.P. Adeno-associated virus vector as a platform for gene therapy delivery. Nat Rev Drug Discov 18, 358-378 (2019).
2. Stamatiou,G. A., Stankovic, K. M., A Comprehensive Network and Pathway Analysis of Human Deafness Genes. Otol Neurotol 34, 961 (2013).
3. Estivill, X. et al., Connexin-26 mutations in sporadic and inherited sensorineural deafness. Lancet 351, 394 (1998).
4. Shu, Y.L. et al. Identification of Adeno-Associated Viral Vectors That Target Neonatal and Adult Mammalian Inner Ear Cell Subtypes. Human gene therapy 27, 687-699 (2016).


