近日,上海科技大学钟桂生(iHuman研究所PI,生命科学与技术学院助理教授)课题组与东南大学柴人杰课题组、上海科技大学何水金(生命科学与技术学院助理教授)课题组合作,利用超分辨率荧光显微技术在骨架蛋白研究中的独特优势,对耳蜗毛细胞表皮板的骨架结构开展研究,共同发现了血影蛋白(Spectrin)以及肌动蛋白(F-actin)在毛细胞表皮板中的全新结构,并揭示上述结构对小鼠听力功能发育的关键作用。研究结果分别以Critical role of spectrin in hearing development and deafness和A cytoskeleton structure revealed by super-resolution fluorescence imaging in inner ear hair cells为题分别发表在Science Advances(北京时间:2019年4月18日在线发表)和Cell Discovery(北京时间:2019年2月19日)杂志上。
I. 背景介绍
截至目前为止,世界范围内罹患残疾性听力损失的人口数目接近4.6亿,听力障碍已成为全球发病率最高的感官缺陷疾病之一,严重影响人们的生活质量。其中大比例听力损伤的原因为:哺乳动物听觉感受器(柯蒂氏器,Organ of Corti)中具有声波振动感受功能的关键感觉上皮细胞——耳蜗毛细胞(hair cell)感知能力的丧失[1]。
耳蜗毛细胞是结构高度特化的细胞类型,其上表面有大量微小的静纤毛(stereocilia)。柯蒂氏器中数以千计的毛细胞通过它们的纤毛敏感地探测声波引发的机械振动,并将机械信号转换为生物电信号,进一步通过与之相连的神经纤维传递给中枢神经系统,声音便由此被感知[2-3]。毛细胞表皮板被认为在哺乳动物听力中发挥关键作用,因其能够稳固静纤毛小根,并为静纤毛提供听觉传导所必要的弹性支持[4-5]。静纤毛小根(rootlet)是静纤毛基部变细并延伸至表皮板中的电子致密结构[6],在毛细胞表皮板的稳固支持下,耐受持续的机械压力,对正常听力功能的维持非常重要。然而,目前针对毛细胞表皮板的研究非常少,毛细胞表皮板这个富含大量骨架蛋白的特殊结构,如何为静纤毛小根提供其必须的稳固性、灵活性支持,目前仍不清楚。
II. 研究成果
针对毛细胞表皮板的结构早期已有光学成像研究。然而,由于阿贝光学衍射极限的存在,常规光学显微镜横向分辨率最高仅能达到200 nm,纵向分辨率约400–700 nm。大多数骨架蛋白的直径均在10纳米以下,因此,传统光学成像方法远远达不到准确观察骨架蛋白在细胞中的精细结构的要求。
Spectrin是自身结构具有高度弹性的蛋白,为细胞的正常形态维持发挥重要作用[7]。早期胶体金免疫电镜工作表明,spectrin在毛细胞表皮板中存在[8]。然而,电镜复杂的样品制备流程极易导致骨架蛋白的破坏,此外,胶体金标记法也无法获得spectrin的连续结构信息。
上海科技大学及东南大学研究人员,将受激发射损耗显微成像技术(Stimulated Emission Depletion Microscopy,STED)应用于小鼠耳蜗组织,对耳蜗毛细胞表皮板开展超高成像研究(见图1),首次清晰地观测到骨架蛋白βII-spectrin在毛细胞表皮板中呈现规律的环状结构。
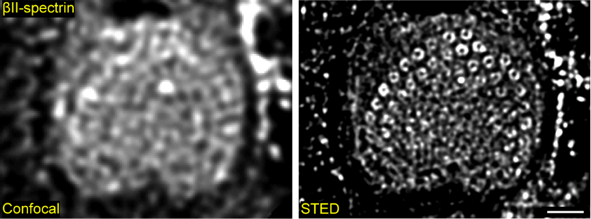
图1. 超分辨荧光显微成像技术首次揭示耳蜗毛细胞表皮板中重要骨架蛋白的超微精细结构

图2. 上科大iHuman成像平台部分超分辨率荧光显微成像设备
有趣的是,研究人员发现毛细胞表皮板spectrin规律环状结构的形成时间是在小鼠出生后第14天左右,这个时间与小鼠听力的形成时期非常接近。因此研究人员构建了老年性听损、噪声暴露等听力损伤小鼠模型,以进一步分析验证spectrin环状结构与听力的相关性。如图3所示,老年性听力损伤模型小鼠中(图3A),spectrin环状结构发生缺失,并且缺失情况在底转的毛细胞中最为严重。?在噪声暴露导致的听损小鼠模型(图3B)中,研究人员同样发现了spectrin环状结构的缺损。并且,在耳蜗毛细胞中特异性敲除βII-spectrin蛋白后,小鼠的毛细胞极性发生紊乱,听力完全丧失。综上,该项工作利用超高分辨率荧光显微成像技术,首次发现了血影蛋白在内耳毛细胞表皮板中的全新结构,并揭示了该结构对哺乳动物听力发育的关键作用。
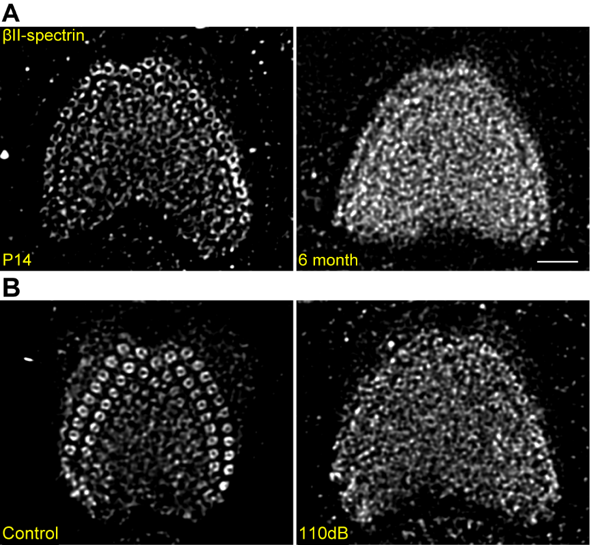
图3. 老年性听损、噪声暴露听损模型鼠中毛细胞表皮板spectrin环状结构发生缺损
此外,研究人员还利用结构光照显微成像技术(Structured Illumination Microscopy, SIM)对表皮板中含量最为丰富的骨架蛋白F-actin开展了3D超高分辨成像,首次发现了F-actin在毛细胞表皮板的全新精细结构(见图4)。
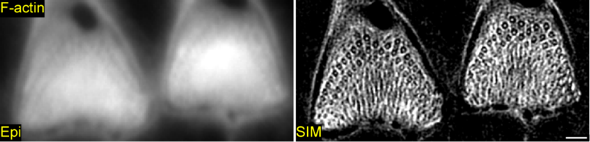
图4. 耳蜗毛细胞表皮板中重要骨架蛋白F-actin的超微精细结构
通过3D SIM,研究人员清楚地观测到F-actin在OHC表皮板拥有非常精密的结构排布规律:F-actin包绕毛细胞静纤毛小根形成两排整齐排列的环状结构;另外,F-actin还在表皮板上呈现扇形放射状结构。在毛细胞表皮板中,F-actin环状结构从表皮板表面向Z轴深处延伸,F-actin环始终包裹静纤毛小根直至完全消失,同时扇形放射状结构从质膜内表面开始出现,向下延伸约600nm。这意味着F-actin在毛细胞表皮板形成具有一定厚度的、有规律排布的网状结构,这对维持表皮板的弹性结构以及静纤毛内蛋白运输可能具有非常重要的作用。
III. 小结展望
超分辨荧光显微成像技术兼具传统光学显微镜快速、无损、可特异性标记等成像优势,并拥有接近纳米尺度的成像分辨率,是衔接传统光镜与电镜成像研究的最佳桥梁,因而在细胞内蛋白及相关分子的研究中具备独特的优势。尤其为直径微小、结构脆弱的细胞骨架蛋白的研究,提供了极佳的技术条件。
上述研究工作利用超高分辨显微成像技术在内耳毛细胞中首次发现了Spectrin、F-actin等重要骨架蛋白在表皮板的精细结构组织方式,并进一步验证了上述结构在小鼠听力发育过程中发挥关键作用。这将推进我们对耳蜗毛细胞表皮板结构与功能的认知,进一步深入解析毛细胞听力损伤的生物学基础,具有重要的研究意义。

图5. 上海科技大学iHuman研究所科研团队合照
(Science Advances论文第一作者为上海科技大学助理研究员刘艳、东南大学博士生齐洁玉、上海科技大学博士生陈鑫,通讯作者为上海科技大学钟桂生、东南大学柴人杰和上海科技大学何水金。Cell Discovery论文第一作者为齐洁玉、刘艳、陈鑫,通讯作者为上海科技大学钟桂生、东南大学柴人杰和上海科技大学何水金。)
本文封面图源:刘卓佳
相关论文原文:
https://advances.sciencemag.org/content/5/4/eaav7803.full
https://www.nature.com/articles/s41421-018-0076-4
Reference:
1. A. K. Groves, The challenge of hair cell regeneration. Experimental biology and medicine 235, 434-446 (2010).
2. A. Flock, B. Flock, E. Murray, Studies on the sensory hairs of receptor cells in the inner ear. Acta oto-laryngologica83, 85-91 (1977).
3. R. S. Kimura, The ultrastructure of the organ of Corti. Int Rev Cytol42, 173-222 (1975).
4. D. J. DeRosier, L. G. Tilney, The structure of the cuticular plate, an in vivo actin gel. J Cell Biol109, 2853-2867 (1989).
5. M. Itoh, Preservation and visualization of actin-containing filaments in the apical zone of cochlear sensory cells. Hear Res6, 277-289 (1982).
6. Furness, D. N., Mahendrasingam, S., Ohashi, M., Fettiplace, R. & Hackney, C. M. The dimensions and composition of stereociliary rootlets in mammalian cochlear hair cells: comparison between high and low frequency cells and evidence for a connection to the lateral membrane. Journal of Neuroscience28, 6342 (2008).
7. I. Koshino, N. Mohandas, Y. Takakuwa, Identification of a novel role for dematin in regulating red cell membrane function by modulating spectrin-actin interaction. J Biol Chem287, 35244-35250 (2012).
8. S. Mahendrasingam, D. N. Furness, C. M. Hackney, Ultrastructural localisation of spectrin in sensory and supporting cells of guinea-pig organ of Corti. Hearing research126, 151-160 (1998).


