近日,上海科技大学iHuman研究所刘志杰/华甜团队在国际学术期刊 Protein & Cell 上发表了题为“Cryo-EM structure of cannabinoid receptor CB1-β-arrestin complex”的研究论文,揭示了大麻素受体CB1(cannabinoid receptor 1)与下游信号转导蛋白β-arrestin-1的复合物三维结构,在分子水平上阐述了同一个小分子激活CB1下游G蛋白以及β-arrestin-1的选择性信号转导机制,进一步完善了大麻素受体配体识别以及信号转导的系统认识。
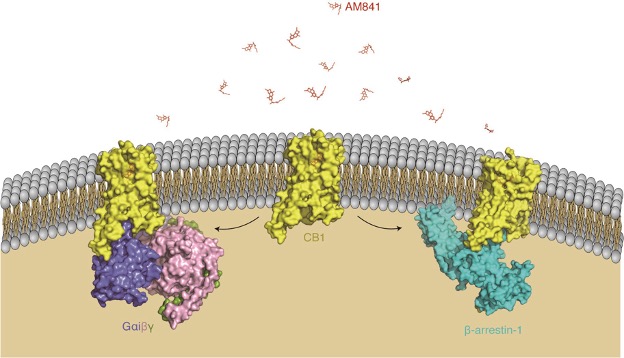
图1. 小分子AM841激活大麻素受体CB1不同信号转导机制的示意图
内源性大麻素系统是维持人体健康的最重要的生理系统之一。大麻素受体CB1和CB2是该系统的关键组成部分,参与调控食欲、疼痛、炎症等多种生理活动。刘志杰/华甜团队长期致力于大麻素受体CB1和CB2的结构药理学研究。在前期的研究中,该团队成功解析了CB1和CB2分别与拮抗剂、激动剂以及下游G蛋白复合物等的高分辨率结构,系统研究了不同配体对大麻素受体的调控机制,还进一步探索了CB1的别构调节机制及CB2高选择性配体分子的研发。这些重要成果分别发表在Cell (2016,2019,2020), Nature (2017), Journal of the American Chemical Society (2021) 以及Nature Communications (2023)等国际知名期刊上。
在上述基础上,本研究进一步探究了大麻素受体CB1的下游偏好性信号转导机制。G蛋白偶联受体被激动剂激活之后,一方面与下游的G蛋白结合,另一方面受到G蛋白偶联受体激酶(G protein-coupled receptor kinases , GRKs)和阻遏蛋白arrestin的调控,介导受体脱敏及一系列的下游信号效应。通过不断优化样品制备和纯化方法,研究团队成功获得了与激动剂小分子AM841结合的CB1与β-arrestin-1复合物的三维结构。结果显示,CB1与β-arrestin-1之间存在一种“核心相互作用”模式,表现出与其它A家族受体相似的结构特征。CB1受体的核心区域与β-arrestin-1相互作用,被GRK磷酸化的CB1的C端与β-arrestin-1的N端区域结合,CB1的TM5与β-arrestin-1的C 环区域靠近,形成疏水作用。该研究进一步揭示插入受体跨膜区域的β-arrestin-1的finger loop具有高度动态性。此外,β-arrestin-1的C端插入去垢剂形成的micelle中,暗示了这一相互作用的复杂性。与同样结合激动剂小分子AM841的CB1-Gi复合物结构相比,两者具有相似的激活构象,CB1的TM6胞内端均向外移动,但结合β-arrestin-1的CB1的TM5胞内端较CB1-Gi复合物发生了更大的外移。这项工作为未来设计具有大麻素受体偏好性的药物提供了重要的结构基础,为更深入了解内源性大麻素系统的复杂机制以及开发针对大麻素受体的治疗药物揭示了新的研究方向。
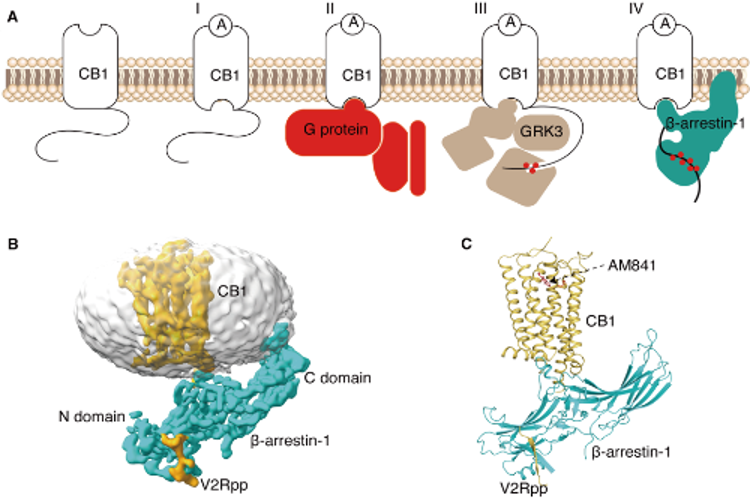
图2. 大麻素受体CB1与β-arrestin-1的复合物三维结构
上海科技大学iHuman研究所研究助理王玉霞、副研究员武丽杰、生命学院2021级博士研究生汪天为共同第一作者;上科大大道书院院长、iHuman研究所执行所长、生命学院教授刘志杰, iHuman研究所研究员、生命学院助理教授华甜为该工作的共同通讯作者。该工作得到上科大生物电镜平台和其它平台的支持,上海科技大学为第一完成单位。


