近日,上海科技大学iHuman研究所的赵素文团队与天津大学张雁团队、新加坡A*STAR/美国伊利诺伊大学厄巴纳-香槟分校的赵惠民团队合作,破解了一个40多年的未解之谜,揭示了一个负责Z-基因组生物合成的多酶系统,相关研究论文于2021年4月30日在《科学》(Science)在线发表。

在与细菌无休止的攻防大战中,噬菌体的脱氧核糖核酸(DNA)经常通过修饰来逃避宿主内切酶的攻击。2-氨基腺嘌呤(Z)就是其中一个例子,它是一种独特的碱基修饰,在噬藻体S-2L的 DNA中完全取代了腺嘌呤(A),与胸腺嘧啶(T)形成具有三根氢键的碱基配对(图1)。自1977年被苏联科学家Ivan Khudyakov发现以来,噬藻体S-2L一直是唯一已知具有Z-基因组的物种。Z-基因组的生物合成通路、存在的广泛性以及它的重要性长期以来一直未知。
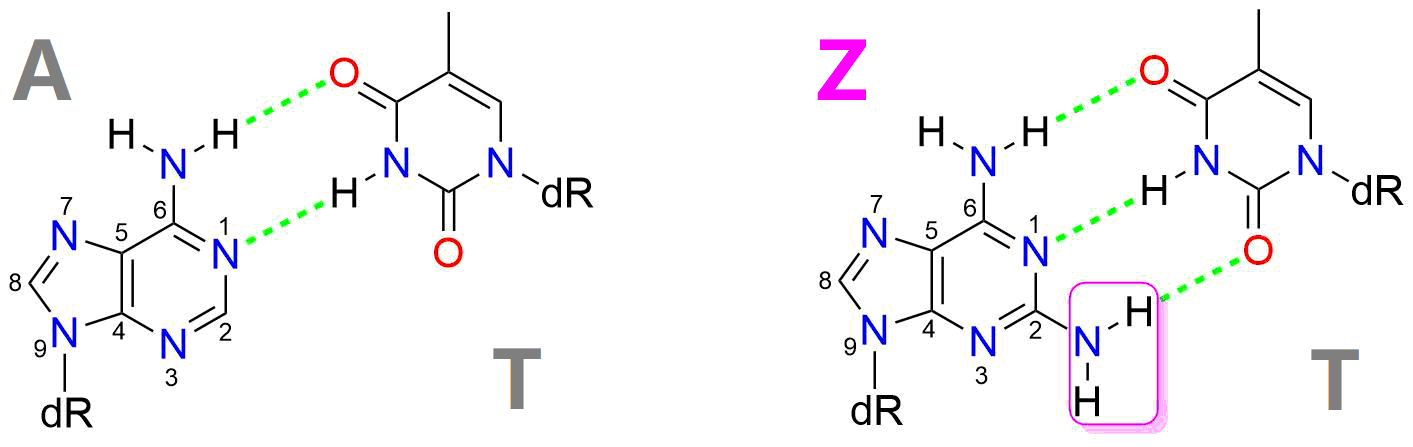
图1. Z-T碱基对有三根氢键,而A-T碱基对只有两根氢键。Z比A多出的官能团是嘌呤环上2位氨基(紫色框)。
赵素文团队及合作者通过生物信息学和生物化学等技术手段,揭示了一个负责Z-基因组合成的多酶系统,由PurZ、dATPase 和DUF550等来自噬菌体的数个酶和若干来自宿主的酶共同组成(图2)。
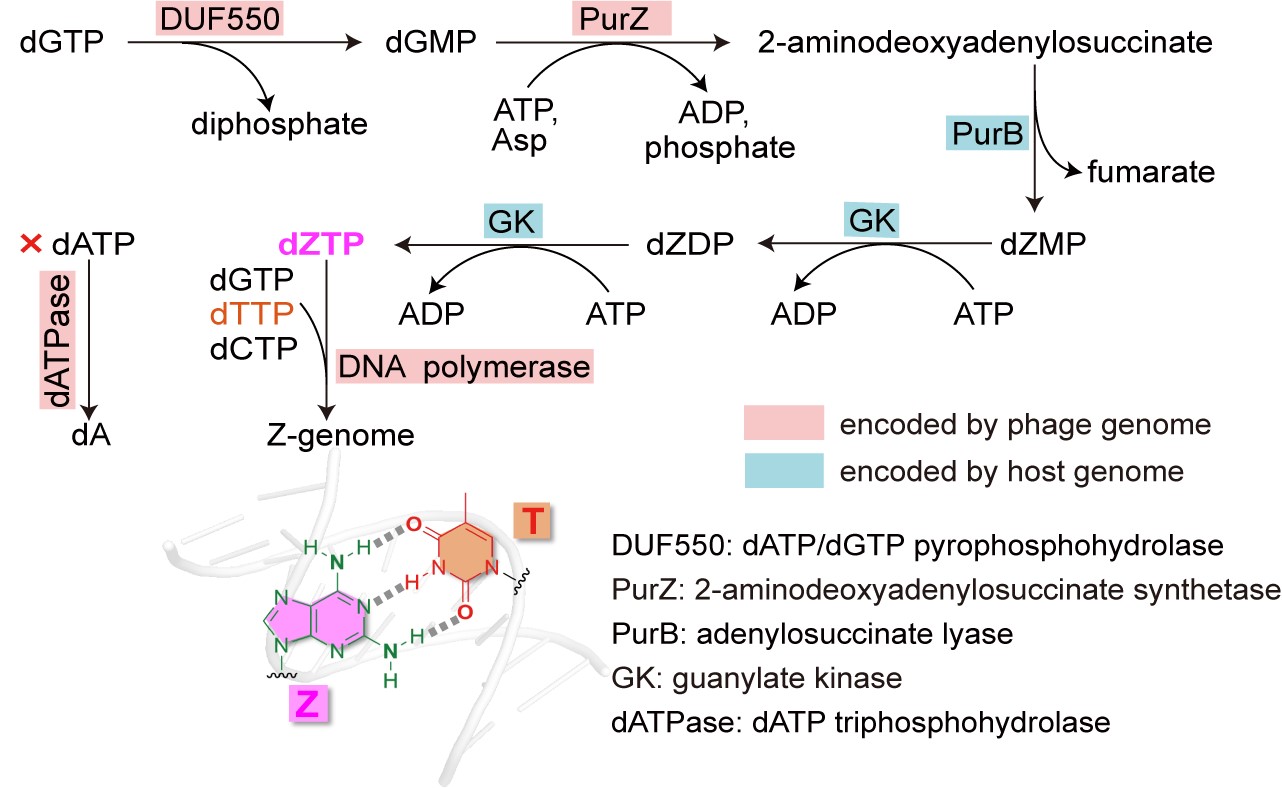
图2. 研究揭示Z-基因组生物合成通路,论文在线发表于国际顶尖学术期刊《科学》
该研究发现近百个分布在全球各地的噬菌体中都含有该通路的关键酶,并因此推断这些噬菌体也都具有Z-基因组。合作团队选取了其中一个在上海被分离的噬菌体Acinetobacter phage SH-Ab 15497来进行多角度的在体实验验证。这些实验都验证了该噬菌体具有Z-基因组,这是继40多年前报道的噬藻体 S-2L含有Z-基因组之后,首次实验验证在噬菌体中也具有Z-基因组,表明Z-基因组在大自然中可能广泛存在。
同时,合作团队进一步验证了Z-基因组的生物学意义。通过使用来自宿主的限制性核酸内切酶和一系列其他内切酶对Acinetobacter phage SH-Ab 15497的Z-基因组的切割实验,合作团队确认,识别位点中含有A的限制性核酸内切酶无法切割Acinetobacter phage SH-Ab 15497的Z-基因组。因此,Z-基因组的生物学意义是使得噬菌体可以逃避宿主内切酶的剪切,从而赋予噬菌体进化上的优势。
合作团队对Z-基因组合成通路、存在的广泛性和生物学意义的研究,使得大规模合成Z-DNA从而展开各种应用研究,如噬菌体疗法、合成生物和DNA存储等成为可能。
该论文由来自多家单位的研究人员合作完成。天津大学药学院博士研究生周彦、上海科技大学iHuman研究所和生命科学与技术学院博士研究生许雪霞、新加坡A*STAR研究所魏易峰为文章的共同第一作者。赵惠民教授、张雁和赵素文为文章的共同通讯作者。上海科技大学iHuman研究所的克隆平台,免疫化学研究所的生物医学大数据平台和化学分析平台也为本研究提供了协助。


